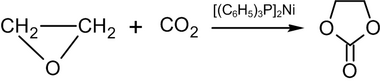Оксиран
| Оксиран[1] | |
|---|---|
 Оксиран |  |
 |  |
Назва за IUPAC | Оксиран |
| Інші назви | Оксид етилену, етиленоксид |
| Ідентифікатори | |
| Номер CAS | 75-21-8 |
| PubChem | 6354 |
| Номер EINECS | 200-849-9 |
| Номер EC | 200-849-9 |
| KEGG | D03474 |
| Назва MeSH | Ethylene+Oxide |
| ChEBI | CHEBI:27561 |
| RTECS | KX2450000 |
| SMILES | C1CO1 |
| InChI | 1/C2H4O/c1-2-3-1/h1-2H2 |
| Номер Бельштейна | 102378 |
| Номер Гмеліна | 676 |
| Властивості | |
Молекулярна формула | C2H4O |
Молярна маса | 44,05 г/моль |
Молекулярна маса | 44 а. о. м. |
| Зовнішній вигляд | безбарвний газ |
Густина | 0,882 кг/м³ |
Тпл | −111,4 °C[2] |
Ткип | 10,7 °C |
Тиск насиченої пари | 145,8 кПа (при 20 °C) |
Діелектрична проникність (ε) | 13,9[3] |
Показник заломлення (nD) | 1,360 (при 8,4 °C)[4] |
Дипольний момент | 1,88—1,91[5] |
| Термохімія | |
Ст. ентальпія утворення ΔfH | -52,6 кДж/моль |
Ст. ентальпія згоряння ΔcH | 308,4—332,5 ккал/моль[6] |
Ст. ентропія S | 243 Дж/(моль·К) |
Теплоємність, c | 48,19 Дж/(моль·К) |
| Небезпеки | |
ГДК (Україна) | 1 мг/м³ |
ЛД50 | 72 мг/кг |
| Головні небезпеки | канцероген |
NFPA 704 |  4 3 3 |
Температура спалаху | -18 °C |
Вибухові границі | 3—100 % |
| Пов'язані речовини | |
| Пов'язані речовини | азірідин, тіїран, боріран |
| Якщо не зазначено інше, дані приведені для речовин у стандартному стані (за 25 °C, 100 кПа) | |
Інструкція з використання шаблону | |
Примітки картки | |
Оксира́н (етиле́нокси́́д) — насичена гетероциклічна сполука з хімічною формулою C2H4O. Це найпростіший циклічний етер. За звичайних умов перебуває у газоподібному стані. Температура кипіння становить 10,7 °C. Добре розчинний у спиртах, ефірі, хлороформі, чотирихлористому вуглеці, ацетоні та інших розчинниках.
Найпоширенішим промисловим методом добування є каталітичне окиснення етилену, коли виробництво оксирану здійснюють у нерухомому шарі каталізатора з рециркуляцією продуктів реакції.
Оксиран різко відрізняється своїми властивостями від етерів: на відміну від них, він має велику схильність до реакцій приєднання[ru] і полімеризації, тобто поводиться як ненасичена сполука.
Токсична речовина. Звичайні симптоми системного отруєння оксираном — головний біль, задишка, нудота і блювання. Поріг сприйняття людиною запаху оксирану — 1,26 мг/л. Гранично допустима концентрація оксирану в повітрі прийнята рівною 1 мг/л[7].
Застосовується в органічному синтезі, зокрема для добування етиленгліколю, який застосовується у виробництві антифризу, як розчинник, пластифікатор, у виробництві мономерів для синтетичних волокон. Оксиран є важливою сировиною для виробництва неіоногенних поверхнево-активних речовин.
Зміст
1 Історія
2 Будова молекули
3 Фізичні властивості
4 Одержання
4.1 Через етиленхлоргідрин
4.2 Газофазне окиснення етилену
4.3 Каталітичне окиснення етилену
4.4 Препаративні методи
5 Хімічні властивості
5.1 Термічне розкладання
5.2 Вибухове розкладання
5.3 Окиснення
5.4 Відновлення
5.5 Ізомеризація
5.6 Полімеризація
5.7 Взаємодія з водою
5.8 Взаємодія з гідроксилвмісними сполуками
5.9 Взаємодія з неорганічними кислотами і їхніми солями
5.10 Взаємодія зі сполуками фосфору, миш'яку, сурми з галогенами
5.11 Взаємодія з органічними кислотами, їхніми ангідридами та естерами
5.12 Взаємодія з азотовмісними основами
5.13 Взаємодія з діоксидом вуглецю
5.14 Взаємодія із сірковмісними сполуками
5.15 Взаємодія з магнійорганічними сполуками
5.16 Взаємодія з ціанідними сполуками
5.17 Взаємодія з вуглеводнями
6 Методи аналізу
6.1 Якісне визначення
6.2 Кількісне визначення
7 Застосування
7.1 У виробництві етиленгліколю
7.2 У процесі синтезу ефірів етиленгліколю
7.3 У виробництві поліетиленгліколів
7.4 У виробництві поліетиленоксиду
7.5 У виробництві поліетилентерефталату
7.6 У виробництві целозольвів
7.7 У виробництві поверхнево-активних речовин
7.8 У виробництві етаноламінів
7.9 Як деемульгатор нафти і нафтопродуктів
7.10 Як фумігант
7.11 У виробництві інших похідних
7.12 В інших галузях
8 Фізіологічна дія
9 Див. також
10 Примітки
11 Джерела
12 Посилання
Історія |

Шарль Адольф Вюрц
Оксиран вперше отримав і описав його основні властивості в 1859 році французький хімік Шарль Адольф Вюрц[8][9][10]. Займаючись вивченням похідних етиленгліколю, Вюрц приготував оксиран дією розчину їдкого калію на {етиленхлоргідрин і визначив, що нова сполука кипить при +13,5 °С, змішується в усіх відношеннях з водою, утворює з сульфатом натрію кристалічну сполуку з освіжаючим смаком, відновлює водний розчин нітрату срібла, але не дає кристалічного осаду при дії ефірного розчину аміаку.
- Cl−CH2−CH2−OH+KOH⟶CH2(O)CH2+KCl+H2Odisplaystyle mathrm Cl-CH_2-CH_2-OH+KOHlongrightarrow CH_2(O)CH_2+KCl+H_2O
Вюрц розглядав оксиран як ангідрид гліколю або його «внутрішній» ефір, відзначаючи, що він є ізомерним до оцтового альдегіду і за деякими властивостями схожий з ним. При подальшому вивченні хімічних властивостей оксирану, Вюрц звернув увагу на те, що ці властивості сильно відрізняються від властивостей звичайних ефірів[11]. Особливо вразило Вюрца те, що оксиран в багатьох реакціях поводить себе аналогічно до основ, здатен нейтралізувати кислоти, осаджувати метали у вигляді їхніх гідроксидів, тобто поводиться як справжня органічна основа. Погляд на оксиран як на сполуку з основними функціями протримався досить довго[12]. Однак Г. Бредіг[en] в 1896 році, вимірюючи електропровідність водних розчинів оксирану, встановив, що останній не є електролітом[13]. У 1907 році А. Ганч вимірював електропровідність водних розчинів етиленхлоргідрину, що утворюється при «нейтралізації» соляної кислоти оксираном[14]. При цьому він встановив, що етиленхлоргідрин також не є електролітом і його не можна зарахувати до класу солей.
У той же період і інші дослідники виступали проти приписування оксирану справжніх основних функцій[15][16].
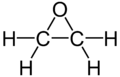
Будова молекули |

Будова молекули оксирану
Вивчення будови молекули оксирану тривало довго і в гострих дискусіях. Одним із головних етапів цього процесу було висунення Байєром своєї «теорії напруження», в якій важливе значення надається спотворенню кутів між напрямками валентностей атомів в молекулах. Відповідно до теорії, це спотворення призводить до накопичення в молекулах своєрідної «енергії напруження» і, як наслідок, до нестійкості і підвищеної реакційної здатності.
У 1908 році, виходячи з того, що фактична теплота згорання 1 моля оксирану на 18 ккал більша, ніж виходить з розрахунку за правилом адитивності, таку розбіжність пояснили у відповідності з теорією Байєра наявністю напруження в тричленному гетероциклі молекули оксирану[17]. Ці «надлишкові» 18 ккал вважалися мірою напруженості гетероциклу оксирану.
Пізніше було визначено, що кут між напрямками валентностей кисню в молекулі оксирану становить 64°, в той час як аналогічний кут в «нормальних» кисневих сполуках дорівнює 105° і навіть 111°.
Висновки, зроблені на основі теорії напруження Байєра для пояснення особливостей властивостей оксирану, були додатково обґрунтовані при електронографічних дослідженнях будови його молекули[18]. Цими даними для оксирану була підтверджена формула будови Вюрца у вигляді тричленного циклу, аналогічно до циклопропану.
Фізичні властивості |
За звичайних умов оксиран перебуває у газоподібному стані. Температура його кипіння становить 10,7 °C. Нижче цієї температури оксиран перебуває у вигляді нейтральної безбарвної досить рухомої рідини.
Чистий оксиран не є провідником електричного струму, проте при розчиненні солей (наприклад, хлориду натрію і особливо нітрату калію), утворює струмопровідні розчини[2]. Деякі дослідники вважають, що водні розчини оксирану не проводять електричного струму[19]. За іншими даними, вони є слабкими провідниками струму, хоча автори пояснюють електропровідність цих розчинів вторинними причинами, зокрема утворенням невеликих кількостей гліколевої кислоти[2].
Константа Трутона, що характеризує приріст ентропії в результаті випаровування рідини при постійній температурі, для нормальних неасоційованих речовин становить 21. Для оксирану вона становить 20,4-21,14, що також відповідає неасоційованій рідині[2][20].
Критичний тиск оксирану становить 49,1 ат[21][22], критична температура рівна 195,8 ºС[21][23].
Оксиран добре розчинний у спиртах, етерах, хлороформі, чотирихлористому вуглеці, ацетоні та інших розчинниках[24]. У оксирані також розчиняється багато газів, наприклад в рідкому оксирані добре розчиняється діоксид вуглецю і етилен[25], а також азот і насичені вуглеводні[26]. З багатьма вуглеводнями, що киплять в межах температур від −7 ºС до +31 ºС, оксиран утворює азеотропні суміші[27].
Одержання |
Через етиленхлоргідрин |
Незважаючи на зростаюче значення способу одержання оксирану прямим окисленням етилену, метод його одержання дегідрохлоруванням етиленхлоргідрину і досі вельми широко застосовується в різних країнах.
Метод одержання оксирану через етиленхлоргідрин включає такі основні реакції:
- утворення етиленхлоргідрину з етилену і хлору у водному середовищі:
- CH2=CH2+Cl2+H2O⟶ClCH2−CH2OH+HCldisplaystyle mathrm CH_2=CH_2+Cl_2+H_2Olongrightarrow ClCH_2-CH_2OH+HCl
- перетворення утвореного етиленхлоргідрину в оксиран при взаємодії з лугами:
- ClCH2−CH2OH+MeOH⟶CH2(O)CH2+MeCl+H2Odisplaystyle mathrm ClCH_2-CH_2OH+MeOHlongrightarrow CH_2(O)CH_2+MeCl+H_2O
Розкладання етиленхлоргідрину у водному розчині проводиться при 95—100 °С. Кількість утвореного оксирану залежить від умов процесу і коливається від 16 до 97%. Для розкладання етиленхлоргідрину пропонується використовувати гідроксид магнію, карбонат барію[28] і їдкий натр (розбавлений або концентрований розчин)[29][30]. Таким способом оксиран можна одержувати за пониженого[31] і підвищеного[32]тиску.
У промисловості оксиран спочатку одержували з концентрованого етиленхлоргідрину[33]. При цьому відбувалася взаємодія концентрованого гарячого розчину лугу з 40%-ним розчином етиленхлоргідрину, отриманого з розбавленого етиленхлоргідрину в цьому ж апараті[34]. Зараз на всіх промислових установках використовують розбавлені розчини етиленхлоргідрину, оскільки концентрування цих розчинів пов'язане з певними труднощами і здорожчує виробництво.
Газофазне окиснення етилену |
При прямому гомогенному окисненні етилену киснем утворюється ряд цінних продуктів: оксиран, формальдегід, органічні кислоти[35]. Доволі довго увага дослідників була зосереджена на процесі окиснення етилену до формальдегіду. Проте не менш привабливим є шлях синтезу оксирану гомогенним окисненням етилену в газовій фазі, оскільки для цього процесу не потрібно витрат ні дорогого каталізатора, ні хлору. Крім того, при цьому способі одержання оксирану не потрібні етилен і повітря такого високого ступеня очищення, як при каталітичному окисненні етилену. До недоліків цього методу відносяться різноманіття утворених продуктів і низька селективність, що пояснюється ланцюговою природою перетворень і високою температурою. Однак розвиток теорії ланцюгових процесів відкриває нові шляхи вдосконалення реакцій газофазного окиснення етилену.
При температурі нижче 300 °С етилен не взаємодіє з киснем, повільне окиснення починається при 300 °С[36]. З підвищенням температури швидкість процесу різко зростає. Оптимальною температурою вважають ту, при якій 65% поданого в зону реакції кисню вступає у взаємодію з етиленом[37].
Каталітичне окиснення етилену |
Можливість неповного окиснення етилену за наявності каталізаторів з одержанням при цьому цінних кисневмісних продуктів була встановлена вже досить давно: із суміші рівних об'ємів етилену і кисню за наявності платини за певних умов утворюється оцтова кислота[38]. Оцтова кислота утворюється також при окисненні етилену киснем на розпеченій платиновій спіралі. Реакція окиснення в значній мірі визначається обраним каталізатором[39].

Оксид срібла — найбільш поширений каталізатор в процесах одержання оксирану
Часткове окиснення етилену з метою одержання формальдегіду проводили на різних каталізаторах: Os, Pt, Ag, Cu, CoSO4[ru], Cr2O3, MnO2[40]. Хоча багато з цих каталізаторів знижують температуру окиснення етилену, але при цьому вони не тільки не сприяють збільшенню виходу формальдегіду, а навіть викликають його розпад.
Найкращим для проведення даного процесу виявився срібний каталізатор. Однак внаслідок його великої чутливості до дії контактних отрут, зокрема сірчистих сполук і ацетилену, вихідні гази, що застосовуються у виробництві оксирану каталітичним методом (повітря, етилен, кисень), повинні ретельно очищатися[41].
У всіх промислових технологічних схемах виробництва оксирану прийнятий процес в нерухомому шарі каталізатора з рециркуляцією продуктів реакції. Цей процес зазвичай проводиться в трубчастих апаратах, причому через трубки, заповнені каталізатором, пропускається реакційна газова суміш, а тепло, що виділяється знімається теплоносієм, який знаходяться в міжтрубному просторі. Надалі стоїть непроста задача виділення чистого продукту. Висока реактивність оксирану становить суттєву технічну проблему при його дистиляції, оскільки за наявних при цьому умов під дією джерела запалювання він може розкладатися з вибухом. Крім того, він схильний разом з наявною водою до утворення гліколів. Було винайдено, що дистиляцію оксирану і оксиранвмісної суміші в колоні при абсолютному тиску від 2 до 10 бар та температурі від 20
до 180 °С з відведенням чистого оксирану в рідкому або газоподібному агрегатному стані через головку або через боковий відвід концентратора колони можна здійснювати шляхом пропускання суміші через кілька розміщених одна за одною зон зі структурованими пакетами металевих пластин або насадками, засипаними наповнювачами, і з яких щонайменше одна зв'язана із системою гасіння, через яку при збільшенні тиску в колоні понад граничне значення ззовні колони в зону (зони) подають рідкий, гасильний засіб, що змішується із оксираном[42]. Енергетично процес оптимізовують використанням вторинної пари[43].
Препаративні методи |
За одним із найстаріших препаративних методів оксиран утворюється внаслідок взаємодії їдкого лугу з β-хлоретилацетатом[44]:
- ClCH2−CHOCOCH3+2KOH⟶CH2(O)CH2+KCl+CH3COOK+H2Odisplaystyle mathrm ClCH_2-CHOCOCH_3+2KOHlongrightarrow CH_2(O)CH_2+KCl+CH_3COOK+H_2O
Реакція відбувається настільки легко, що її використовують як лабораторний метод одержання оксирану[45].
Оксиран утворюється з хорошим виходом при дії неорганічних основ на етилгіпохлорит[46]:
- ClOCH2−CH3+NaOH⟶CH2(O)CH2+NaCl+H2Odisplaystyle mathrm ClOCH_2-CH_3+NaOHlongrightarrow CH_2(O)CH_2+NaCl+H_2O
При заміні їдкого натру на оксид кальцію вихід оксирану досягає 90%. Реакція проводиться в герметично закритій посудині, оснащеній манометром і зворотним холодильником. Нагрів проводять на масляній бані. У посудину завантажують розчин їдкого лугу або оксид кальцію і додають водний розчин гіпохлориту.
Інший препаративний метод одержання α-оксидів полягає у взаємодії дигалогенпохідних алканів з оксидами металів. За цим методом оксиран можна одержати з дигалогенпохідних етану при реакції їх з оксидом срібла[47]:
- ICH2−CH2I+Ag2O⟶CH2(O)CH2+2AgIdisplaystyle mathrm ICH_2-CH_2I+Ag_2Olongrightarrow CH_2(O)CH_2+2AgI
При використанні 1,2-дийодоетану реакційну суміш необхідно нагрівати до 150 °С, при використанні 1,2-диброметану — до 250 °С. Якщо замість оксиду срібла застосовується оксид натрію, то реакція проводиться при 150 °С.
Хімічні властивості |
Термічне розкладання |
Оксиран відрізняється відносно високою термічною стійкістю, вона помітно не змінюється при відсутності каталізаторів навіть при 300 °C. Але при 570 °С оксиран розкладається, причому в інтервалі 570—1200 °С ця реакція є екзотермічною[48]. Виходячи з отриманих продуктів піролізу, були запропоновані наступні схеми реакцій, що відбуваються при термічному розкладанні:
- 4CH2(O)CH2⟶4HCHO+C4H8displaystyle mathrm 4CH_2(O)CH_2longrightarrow 4HCHO+C_4H_8
- CH2(O)CH2→−H2O HC≡CH →+H2 H2C=CH2displaystyle mathrm CH_2(O)CH_2xrightarrow[-H_2O] HCequiv CH xrightarrow +H_2 H_2C=CH_2
- CH2(O)CH2⟶CH3CHOdisplaystyle mathrm CH_2(O)CH_2longrightarrow CH_3CHO
Збільшення швидкості розкладу оксирану за наявності водню свідчить про те, що при звичайних тисках ця реакція є бімолекулярною[49].
Оксиран також розкладається і під дією ультрафіолетових променів[50]. Продуктами розпаду за наявності ртуті при кімнатній температурі є оксид вуглецю, водень, альдегіди (в основному оцтовий та вищі), метан, етан, пропан і невелика кількість радикалів •CH—CO•[51].
Термічний розпад оксирану гальмується пропіленом[52]. Інгібуюча дія пропілену, ймовірно, полягає в тому, що він, реагуючи з радикалами R ланцюгової реакції, утворює RH і алільні радикали, які потім рекомбінуються в діаліл і обривають ланцюг.
Вибухове розкладання |

Гримуча ртуть
Рідкий оксиран дуже стабільний у відношенні до детонуючих агентів[53]. Однак його випари з повітрям легко спалахують і є вибухонебезпечними. Займання може статися внаслідок різних причин: під дією гримучої ртуті Hg(ONC)2displaystyle mathrm Hg(ONC)_2 , нагрітого платинового дроту, статичної електрики, при розкладанні ацетиленідів металів, при підводі великої кількості тепла. Ініціаторами займання можуть служити також тліюче вугілля або вугільні відкладення внаслідок їх здатності до самозаймання через сорбцію кисню повітря, а також «гарячі» точки на каталізаторі, що використовується при різних синтезах за участю оксирану.
Одним з головних ініціаторів займання випарів оксирану є відкритий вогонь. При вибуху їх утворюються кисень, водень, метан, оксид і діоксид вуглецю, етан і етилен. При нормальному тиску і кімнатній температурі нижня і верхня вибухові межі випарів оксирану в суміші з повітрям становлять відповідно 3 і 80%[54][55]. За іншими даними, верхня вибухова межа дорівнює 100%[56][57].
При аналізі продуктів, що утворюються при вибуховому займанні оксирану, можна дійти висновку, що під час цього процесу одночасно відбуваються такі реакції[58][59]:
- CH2(O)CH2⟶CH4+COdisplaystyle mathrm CH_2(O)CH_2longrightarrow CH_4+CO
- 2CH2(O)CH2⟶C2H4+2CO+2H2displaystyle mathrm 2CH_2(O)CH_2longrightarrow C_2H_4+2CO+2H_2
Окиснення |
При окисненні оксирану в залежності від умов реакції і природи окисника утворюються або гліколева кислота, або (при глибокому окисненні) діоксид вуглецю і вода. Оксиран окиснює багато окисників у водних розчинах і навіть повітря за наявності губчастої платини[60]. При його окисненні у водному розчині нітратом срібла утворюється гліколева кислота[61]:
- CH2(O)CH2→H2OAgNO3 HOOC−CH2OHdisplaystyle mathrm CH_2(O)CH_2xrightarrow[H_2O]AgNO_3 HOOC-CH_2OH
Відновлення |
За наявності амальгами натрію оксиран можна відновити воднем в етанол[62][63]:
- CH2(O)CH2+H2⟶CH3CH2OHdisplaystyle mathrm CH_2(O)CH_2+H_2longrightarrow CH_3CH_2OH
Оксиран може відновлюватися до алкену, якщо його суміш з триетилфосфітом нагрівати в автоклаві в атмосфері азоту (тиск 3,5 атм, температура 174 °С)[64]. При цьому триетилфосфіт переходить в триетилфосфат.
Ізомеризація |
Ізомеризація оксирану в ацетальдегід була вперше виявлена через появу запаху останнього при дії на газоподібний оксиран хлориду цинку[65]. Процес можна зобразити так:
- CH2(O)CH2→ZnCl2 CH3CHOdisplaystyle mathrm CH_2(O)CH_2xrightarrow ZnCl_2 CH_3CHO
При пропусканні оксирану над активним оксидом алюмінію[66] при 200—300 °С і над іншими каталізаторами[67] також відбувається ізомеризація в ацетальдегід. Але за відсутності каталізатора оксиран, що проходить через розпечену трубку, ізомеризується лише при 500 °С. При пропусканні оксирану над оксидом алюмінію при 200 °С відбувається не тільки його ізомеризація в ацетальдегід, а й димеризация з утворенням діоксану[ru][68].
Оксиран ізомеризується в ацетальдегід і над срібним каталізатором при 323 °С[69][70]. Утворений ацетальдегід за наявності кисню дуже швидко окиснюється до діоксиду вуглецю і води.
Полімеризація |
Рідкий оксиран під впливом різних факторів виявляє схильність до полімеризації. Утворення полімерів при здійсненні синтезів на основі оксирану (наприклад, одержання поверхнево-активних речовин) може призвести до серйозних порушень процесу, що різко погіршить якість кінцевого продукту[71].
Полімеризація оксирану може відбуватися при високій температурі під впливом матеріалу посудини при збільшеному відношенні поверхні посудини до її об'єму (тобто при використанні насадки)[71].
Полімеризація супроводжується виділенням тепла в кількості 20—30 ккал/моль, а оскільки теплота випаровування оксирану становить лише 6,1 ккал/моль, то при швидкому процесі полімеризації в посудині може створитися вельми високий тиск випарів оксирану, що приводить до вибуху[72]. Такі випадки неодноразово спостерігалися на практиці[73].
Процес полімеризації оксирану залежить від типу каталізатора, температури, характеру середовища та інших факторів. При полімеризації утворюється не однорідний продукт, а суміш полімерів різної молекулярної маси. Залежно від ступеня полімеризації утворюються рідкі, тверді або воскоподібні речовини. Методами рентгеноструктурного аналізу встановлено, що тверді полімери мають кристалічну структуру[74].
Процес полімеризації оксирану складається з ряду послідовних його взаємодій з водою і полігліколями[73]:
- CH2(O)CH2+HOH⟶HO−CH2CH2−OHdisplaystyle mathrm CH_2(O)CH_2+HOHlongrightarrow HO-CH_2CH_2-OH
- HO−CH2CH2−OH+CH2(O)CH2⟶HO−CH2CH2−O−CH2CH2−OHdisplaystyle mathrm HO-CH_2CH_2-OH+CH_2(O)CH_2longrightarrow HO-CH_2CH_2-O-CH_2CH_2-OH
Взаємодія з водою |

Етиленгліколь — на його виробництво витрачається левова частка всього оксирану
Оксиран змішується з водою в усіх співвідношеннях. Його розчин у воді при кімнатній температурі досить стійкий. Якщо витримувати 0,5%-ий розчин оксирану у воді при кімнатній температурі протягом 22 діб, то лише 50% від початкової кількості розчиненої речовини вступить у взаємодію з розчинником[75]. Стійкою є також і суміш випарів оксирану і води при температурах близько 200 °С. Проте достатньо лише невеликих кількостей каталізатора, і реакція утворення етиленгліколю відбудеться швидко навіть при кімнатній температурі.
Реакція між оксираном і водою сильно каталізується водневими іонами і особливо сульфатною кислотою[76]. При гідратації оксирану у паровій фазі за наявності фосфорної кислоти, силікагелю або торію утворюється альдегід, а не гліколь[77]. Оксид срібла і алюміній каталізують гідратацію оксирану до етиленгліколю. Передбачається, що реакція відбувається через утворення проміжного адсорбційного комплексу[77]
Ag2O+H2O⟶Ag2O⋅H2Odisplaystyle mathrm Ag_2O+H_2Olongrightarrow Ag_2Ocdot H_2O ,
який реагує з оксираном
- Ag2O⋅H2O+CH2(O)CH2⟶(CH2OH)2⋅Ag2O⟶HO−CH2OH+Ag2Odisplaystyle mathrm Ag_2Ocdot H_2O+CH_2(O)CH_2longrightarrow (CH_2OH)_2cdot Ag_2Olongrightarrow HO-CH_2OH+Ag_2O
Взаємодія з гідроксилвмісними сполуками |
За звичайних умов оксиран ще менше схильний до взаємодії з етанолом, ніж з водою. У паровій фазі він також вельми важко реагує зі спиртом[78]. Реакцію між спиртами і оксираном можна здійснити або при нагріванні суміші в автоклаві, або після додавання до неї каталізатора. Залежно від кількості оксирану утворюються моноалкільні етери етиленгліколю або полігліколі:
- CH2(O)CH2+C2H5OH⟶HO−H2CCH2−OC2H5displaystyle mathrm CH_2(O)CH_2+C_2H_5OHlongrightarrow HO-H_2CCH_2-OC_2H_5
- CH2(O)CH2+HO−H2CCH2−OC2H5⟶HO−CH2CH2−O−CH2CH2−OC2H5displaystyle mathrm CH_2(O)CH_2+HO-H_2CCH_2-OC_2H_5longrightarrow HO-CH_2CH_2-O-CH_2CH_2-OC_2H_5
Каталізаторами для цих процесів можуть служити сполуки кислотного та лужного характеру[79][80][81].
Оксиран може конденсуватися з багатоатомними спиртами[82]. При етерифікації продуктів конденсації вищими жирними кислотами утворюються чудові емульгатори. Навіть така складна речовина, як целюлоза, здатна конденсуватися з оксираном. При дії на целюлозу (бавовняна вата або тканина) оксирану при 50 °С утворюється сполука, в якій одна оксиетильна група припадає на 32 моносахаридних залишки C6H10O6[83]. Наявність розведеного лугу збільшує швидкість етерифікації. Етерифікацію целюлози газоподібним оксираном можна проводити за наявності кислотних каталізаторів або при підвищеному тиску[84].
Взаємодія з неорганічними кислотами і їхніми солями |
Оксиран і його гомологи у водних розчинах легко реагують з галогеноводнями, утворюючи галогенгідрини:
CH2(O)CH2+HX→H2O HOCH2−CH2X+H2Odisplaystyle mathrm CH_2(O)CH_2+HXxrightarrow H_2O HOCH_2-CH_2X+H_2O
У водних розчинах хлороводень спочатку приєднується до оксирану з великою швидкістю, але реакція не доходить до кінця[85]. Навіть у концентрованій хлоридній кислоті не вдається перетворити на етиленхлоргідрин понад 60% оксирану. Це пояснюється тим, що одночасно відбувається побічна реакція утворення етиленгліколю. Якщо в холодну концентровану соляну кислоту ввести значну кількість оксирану, особливо без достатнього перемішування, то реакція іноді проходить настільки бурхливо, що супроводжується вибухом.
Особливим чином взаємодіє оксиран із фтороводнем. При дії оксирану на водний розчин фтороводню флуоргідрин не утворюється[86]. А при його пропусканні в 30%-ний розчин плавикової кислоти утворюється етиленгліколь з невеликими домішками діетиленгліколю[87].
Оксиран здатен у водних розчинах витісняти гідроксиди багатьох металів з їхніх солей. Наприклад, при його взаємодії з хлоридом марганцю[ru] випадає осад гідроксиду марганцю[ru]:
- CH2(O)CH2+MnCl2→H2OHOCH2−CH2Cl+Mn(OH)2displaystyle mathrm CH_2(O)CH_2+MnCl_2xrightarrow H_2OHOCH_2-CH_2Cl+Mn(OH)_2
Реакцію оксирану з солями металів рекомендується використовувати для очищення хлорованих вуглеводнів від солей різних металів[88].
Взаємодія зі сполуками фосфору, миш'яку, сурми з галогенами |
При взаємодії оксирану з п'ятихлористим фосфором утворюється дихлороетан[ru][89]. З трихлористим фосфором утворюються хлоретилові етери фосфітної кислоти та її хлороангідриди[90].
Аналогічно до трихлористого фосфору взаємодіє з оксираном і трихлористий миш'як[ru][91]. Утворені хлоретилові ефіри миш'яковистої кислоти[ru] — це безбарвні рідини, що легко гідролізують.
Трихлориста сурма[ru] при кімнатній температурі легко конденсується з оксираном, утворюючи повні і неповні ефіри[92]:
- SbCl3+3CH2(O)CH2⟶(ClCH2CH2O)3Sbdisplaystyle mathrm SbCl_3+3CH_2(O)CH_2longrightarrow (ClCH_2CH_2O)_3Sb
- SbCl3+2CH2(O)CH2⟶(ClCH2CH2O)2SbCldisplaystyle mathrm SbCl_3+2CH_2(O)CH_2longrightarrow (ClCH_2CH_2O)_2SbCl
Взаємодія з органічними кислотами, їхніми ангідридами та естерами |
При реакції оксирану з органічними кислотами утворюються моноефіри гліколей, з ангідридами кислот — повні ефіри гліколей.
Оцтовокислі ефіри етиленгліколю були одержані при нагріванні оксирану з оцтовою кислотою і оцтовим ангідридом[93]:
- CH2(O)CH2+CH3COOH⟶HOCH2−CH2OOCCH3displaystyle mathrm CH_2(O)CH_2+CH_3COOHlongrightarrow HOCH_2-CH_2OOCCH_3
- CH2(O)CH2+(CH3CO)2O⟶CH3COOCH2−CH2OOCCH3displaystyle mathrm CH_2(O)CH_2+(CH_3CO)_2Olongrightarrow CH_3COOCH_2-CH_2OOCCH_3
Обидва процеси мають промислове значення. Каталізаторами для них можуть служити сульфатна кислота[94], хлорид заліза(III)[95], підкислені гідросилікати (pH не більше 3)[94].
Естери, одержані поліоксиетилюванням нафтенових кислот, мають високу поверхневу активність[96]. 3-Метокси-4-оксибензойна кислота, оброблена оксираном за наявності алкоголяту натрію, дає міцну і хімічно стійку плівку[97].
Продукт конденсації поліакрилової кислоти[ru] з оксираном застосовується як емульгатор. При конденсації оксирану з ангідридами багатоосновних кислот утворюються цінні високомолекулярні продукти[98][99].
Взаємодія з азотовмісними основами |
Реакція оксирану з аміаком, що призводить до утворення етаноламінів[100], зважаючи на цінні властивості останніх і їхніх найпростіших похідних, набула великого промислового значення. Абсолютно сухі оксиран і аміак не взаємодіють, але для того, щоб почалась реакція, досить невеликої кількості води[101]. Така роль води поширюється і на реакції оксирану з амінами.
Через велику реакційну здатність етаноламіни використовуються для синтезу різноманітних продуктів, що застосовуються в текстильній, шкіряній та парфумерній промисловості. Етаноламіни широко застосовуються при очищенні газів від сірководню, діоксиду вуглецю, ціаністого водню і т. д. та в інших галузях[102][103][104].
Продукти конденсації оксирану з різними аміносполуками використовуються як місцеві анестезуючі засоби[105][106], емульгатори жирів і восків[107], поверхнево-активні речовини, дезінфекційні засоби[108], змочувальні і диспергуючі агенти[109] та ін.
Взаємодія з діоксидом вуглецю |
Оксиран при нагріванні взаємодіє з з надлишком діоксиду вуглецю при 110—215 °С під високим тиском із застосуванням тетраетиламоніййодиду як каталізатора[110]. Продуктом реакції є етиленкарбонат. Каталізаторами одержання етиленкарбонату можуть також служити безводні хлориди кальцію і магнію[111].
Етиленкарбонат останнім часом привернув до себе увагу як відмінний розчинник високомолекулярних сполук, а також як реагент, що використовується при реакціях приєднання або конденсації з розривом циклу в сполуках з активними атомами водню.
Взаємодія із сірковмісними сполуками |
Оксиран взаємодіє із сірковмісними сполуками за зв'язком S—H[112]. Зокрема він реагує із сірководнем, причому реакція прискорюється наявністю речовин, що містять гідроксильну групу[113]. Найбільш ефективно реакція відбувається за наявності води. Наприклад, після десятиденного витримування еквімолярної суміші води, сірководню та оксирану утворюється тіоетиленгліколь з майже теоретичним виходом:
- CH2(O)CH2+H2S⟶HSCH2CH2OHdisplaystyle mathrm CH_2(O)CH_2+H_2Slongrightarrow HSCH_2CH_2OH
Оксиран взаємодіє з різними меркаптанами[114]. Цю реакцію можна використовувати для приготування органічних сульфідів[115].
Одержано велику кількість різних тіооксидів, які поки широко не застосовуються, але продукти їх конденсації з іншими сполуками використовуються в промисловості[116].
Взаємодія з магнійорганічними сполуками |
Реакція між оксираном і магнійорганічними сполуками є загальним методом синтезу спиртів з подовженим ланцюгом.
При взаємодії оксирану з реактивом Гриньяра в ефірному розчині після розкладання реакційної суміші водою утворюються відповідний спирт і етиленгалогенгідрин. Ця реакція широко використовується для синтезу складних спиртів та інших сполук[117]. Ацетиленові спирти одержували при взаємодії надлишку оксирану, розчиненого в ефірі, з ацетиленідом магнію[118]. При гідролізі одержаних сполук виділявся ацетиленовий спирт RC≡C-CH2CH2OH з 40%-ним виходом.
Взаємодія з ціанідними сполуками |
Синильна кислота досить повільно приєднується до оксирану в безводному середовищі при 50—60 °С з утворенням етиленціангідрину[119]:
- CH2(O)CH2+HCN⟶HOCH2CH2CNdisplaystyle mathrm CH_2(O)CH_2+HCNlongrightarrow HOCH_2CH_2CN
Також малою є швидкість цієї реакції і в інертному розчиннику. Однак за наявності галогенідів лужноземельних металів або їхніх роданідів швидкість реакції збільшується більш ніж у два рази.
Реакція утворення етиленціангідрину має велике промислове значення, оскільки є проміжною стадією при одержанні акрилонітрилу[120] і ефірів акрилової кислоти[121].
Взаємодія з вуглеводнями |
Оксиран за наявності відповідних каталізаторів може взаємодіяти і з вуглеводнями за зв'язком C—H. Наприклад, при пропусканні парів оксирану і хлороводню в бензен за наявності хлориду алюмінію утворюється дибензил з домішками β-фенілетилового спирту[122]. Крім хлориду алюмінію можна використовувати фторид бору[ru] або безводне хлорне залізо[123], а також безводний фтороводень[124].
На конденсацію оксирану з бензеном сприятливо діє низька температура (5—6 °С). При цьому отримують високий вихід β-фенілетилового спирту[123]. Для зменшення утворення побічних продуктів рекомендується підвищувати тиск і вводити добавки аміаку або амінів, що зв'язують утворений хлороводень.
Конденсація оксирану з металовмісними похідними вуглеводнів відбувається за схемою[125]:
- CH2(O)CH2+RNa⟶RCH2CH2ONadisplaystyle mathrm CH_2(O)CH_2+RNalongrightarrow RCH_2CH_2ONa
Методи аналізу |
Якісне визначення |
Велика частина якісних реакцій на оксиран базується на так званій «псевдоосновності» цієї сполуки, тобто на її здатності поводити себе подібно до сильної основи, витісняючи гідроксиди багатьох металів з їх солей. Цю властивість ще в 1860 році відзначив Вюрц, який запропонував специфічний метод виявлення оксирану, оснований на осадженні оксиду міді при його пропусканні в підігрітий аміачний розчин сульфату міді[126].
Якісною реакцією на оксиран може служити також наступна реакція[127]:
- CH2(O)CH2+NaCl+H2O⟶Cl−CH2CH2−OH+NaOHdisplaystyle mathrm CH_2(O)CH_2+NaCl+H_2Olongrightarrow Cl-CH_2CH_2-OH+NaOH
Утворений гідроксид натрію легко визначається за допомогою фенолфталеїну.
Як реактив на оксиран можна використовувати насичений розчин хлориду марганцю[ru][128][36]. При їхній взаємодії випадає осад гідроксиду марганцю[ru]:
- 2CH2(O)CH2+MnCl2+2H2O⟶2Cl−CH2CH2−OH+Mn(OH)2displaystyle mathrm 2CH_2(O)CH_2+MnCl_2+2H_2Olongrightarrow 2Cl-CH_2CH_2-OH+Mn(OH)_2
Для виявлення пари оксирану в повітрі існує два методи:
- пропускання повітря через свіжоприготовлений насичений розчин йодиду калію, що містить фенолфталеїн: яскраво-рожеве забарвлення з'являється через дві хвилини;
- пропускання повітря через насичений розчин тіосульфату натрію, який містить фенолфталеїн: при наявності в повітрі оксирану рожеве забарвлення з'являється миттєво, тобто другий метод є більш чутливим.
Для якісного визначення оксирану можна користуватися індикаторним папером, просякнутим спеціальним розчином, що містить тіоціанат калію[ru] і залізо-амонійні галуни.
Для визначення оксирану можна використати якісну реакцію на епоксидні сполуки, яка базується на виникненні рожевого забарвлення при кип'ятінні водного розчину п-фенілендіаміну з речовиною, що містить епоксидну групу[129]. Реакція застосовується для визначення епоксидних груп у епоксидних полімерах (при відсутності або після попереднього видалення інших полімерів).
Кількісне визначення |
Спочатку визначення оксирану здійснювалося виключно у водних розчинах. Використовувались розчини мінеральних кислот, що містять солі лужних або лужноземельних металів, такі, як хлориди, броміди, йодиди, тіоціанати[130][131]. Як реагент застосовували також насичений на холоді водний розчин сульфіту натрію[132], що не містить вільної кислоти, або водний розчин тіосульфату натрію[133].
Як добре розчинні солі запропоновані: хлорид натрію[134], хлорид або бромід магнію[ru][135], хлорид кальцію[136]. У всіх трьох методах оксиран реагує з насиченим розчином відповідної солі в розчині соляної або сірчаної кислоти, а потім надлишок кислоти відтитровують розчином лугу за наявності метилового оранжевого[134] або фенолфталеїну[136].
Найстарішим методом кількісного визначення оксирану є метод, в основі якого лежить окиснення оксирану біхроматом калію, надлишок якого визначають йодометрично[137]. При окисненні молекула оксирану повністю руйнується з утворенням діоксиду вуглецю і води:
- 3CH2(O)CH2+5K2Cr2O7+20H2SO4⟶5K2SO4+5Cr2(SO4)3+6CO2+26H2Odisplaystyle mathrm 3CH_2(O)CH_2+5K_2Cr_2O_7+20H_2SO_4longrightarrow 5K_2SO_4+5Cr_2(SO_4)_3+6CO_2+26H_2O
Метод окиснення перйодатною кислотою[ru] є точним і зручним методом аналізу оксирану (точність методу становить 0,1—0,2%). Як реагент використовується 1%-ний розчин перйодатної кислоти в розведеній перхлоратній кислоті[138]. Перхлоратна кислота не реагує з оксираном і з перйодатом, а служить лише для збільшення концентрації іонів водню, помітно прискорюючи гідратацію оксирану:

Сучасний калориметр
- CH2(O)CH2+H2O→H+ HOCH2−CH2OHdisplaystyle mathrm CH_2(O)CH_2+H_2Oxrightarrow H^+ HOCH_2-CH_2OH
Утворений етиленгліколь потім кількісно окиснюється перйодатною кислотою:
- HOCH2−CH2OH+HIO4⟶2HCHO+HIO3+H2Odisplaystyle mathrm HOCH_2-CH_2OH+HIO_4longrightarrow 2HCHO+HIO_3+H_2O
Колориметричний метод передбачає гідратацію оксирану до етиленгліколю, в результаті взаємодії якого з NaIO4 утворюється формальдегід[139]. Його визначають спектрофотометричним методом за реакцією з натрієвою сіллю хромотропової кислоти в концентрованій сульфатній кислоті.
Для визначення оксирану, діоксиду вуглецю та етилену в повітрі за наявності водяної пари сконструйований двоступінчастий хроматограф зі схемою потоку, при якій фракції, що виходять з обох спіральних колонок, надходять в одну і ту ж комірку для вимірювання теплопровідності[140]. Довжина першої колонки дорівнює 5 м, в ній поміщений целіт 545 з н-октадеканом (40% від кількості носія). Довжина другої колонки дорівнює 2,5 м, в ній знаходиться силікагель (розмір часток 175—417 мк). Газ-носій — гелій.
Застосування |
У виробництві етиленгліколю |

Антифриз складовою якого є етиленгліколь
Основним похідним оксирану є продукт його гідратації — етиленгліколь, який використовується для виробництва антифризу, поліетилентерефталату, олігоефіракрилатів, поліалкіленглікольмалеїнатів, целофану, поліуретанів, входить до складу гальмівних та гартувальних рідин, застосовується як розчинник, пластифікатор, у виробництві мономерів для синтетичних волокон та ін. Основні галузі застосування етиленгліколю — хімічна, текстильна, автомобільна, авіаційна, електротехнічна.
У процесі синтезу ефірів етиленгліколю |
Етери етиленгліколю, які одержують з оксирану і спиртів — метилового, етилового і бутилового, є прекрасними розчинниками і широко використовуються у лакофарбовій промисловості. Динітроетиленгліколь вже багато років застосовується як замінник нітрогліцерину для одержання низькозамерзаючого і менш чутливого до удару динаміту або як добавка до нітрогліцерину для зниження його температури замерзання[141], до піроксиліну — для його пластифікації[142] і т. д.
У виробництві поліетиленгліколів |
Діетиленгліколь застосовується для виробництва поліефірних смол і пінопластів, як селективний розчинник для виділення ароматичних вуглеводнів у процесі платформінгу, для очищення і осушення вуглеводневих газів та ін.
Поліетиленгліколь, який одержують полімеризацією оксирану під дією гліколів і лужних каталізаторів, застосовується у фармацевтичній промисловості, косметиці і у виробництві кераміки як згущувач, в текстильній промисловості як антистатик і змочувач, компонент гідравлічних рідин і аерозольних композицій, деемульгатор нафти, в синтезі поліуретанів.
У виробництві поліетиленоксиду |
Здатність оксирану полімеризуватися і співполімеризуватися з іншими мономерами відома давно. З оксирану, в залежності від ступеня його полімеризації отримують полімери з різними характеристиками. Рідкі та воскоподібні або напівтверді полімери можуть використовуватися як пластифікатори, мастильні агенти, а також як речовини, що підвищують розчинність деяких сполук або збільшують проникаючу здатність певних розчинників, тощо[143]. Тверді полімери та кополімери оксирану з іншими мономерами, отримані в блоках або з розчинів (з молекулярною масою до двох мільйонів), мають дуже цінні фізико-механічні властивості і придатні для використання в різних галузях промисловості. На основі поліоксирану розроблені композиції, придатні для виготовлення твердих електролітів[144] та зниження гідродинамічного опору в трубопроводах[145].
У виробництві поліетилентерефталату |
Поліетилентерефталат одержують взаємодією оксирану з терефталевою кислотою. Він є важливою складовою полімерної індустрії. Застосовується для виготовлення поліефірних волокон, плівок, литих виробів. Його широко використовують у машинобудуванні, хімічній промисловості, харчовому обладнанні, транспортних і конвеєрних технологіях, медичній промисловості, приладобудуванні і побутовій техніці.
У виробництві целозольвів |
Целозольви одержують в результаті взаємодії оксирану із спиртами. Застосовують як розчинники ефірів целюлози, природних і синтетичних смол, як компонент розчинників для зняття старих лакофарбових покриттів, присадки до реактивного палива. Також використовують при синтезі пластифікаторів.
У виробництві поверхнево-активних речовин |
При реакціях оксирану з алкілфенолами, жирними спиртами, жирними кислотами і меркаптанами утворюються неіоногенні детергенти, причому їх фізичні та хімічні властивості можна змінювати в потрібних напрямках[146]. Одним з основних переваг цих детергентів є те, що стічні води, які містять їх домішки, легко піддаються біологічному очищенню. Особливо ефективним є застосування неіоногенних поверхнево-активних речовин у нафтовидобувній і нафтопереробній промисловості, так як при їх використанні збільшується кількість добутої нафти, полегшується процес руйнування нафтових емульсій, а отримана нафта містить мінімальну кількість солей і вологи, що полегшує її подальшу переробку.
У виробництві етаноламінів |
Етаноламіни застосовуються в хімічній, газовій та нафтопереробній промисловості для очищення газів від сірководню, діоксиду вуглецю і деяких інших домішок; як основи для практично нейтральних мил, що використовуються в текстильній, шкіряній та інших галузях промисловості; як стабілізатори органічних сполук.
Як деемульгатор нафти і нафтопродуктів |
Нафта і нафтопродукти утворюють з водою небажані, проте доволі стійкі емульсії. Наприклад, стійкі емульсії утворюються при розігріві мазуту гострою парою. Стабілізаторами таких емульсій є асфальтени, вміст яких у паливних мазутах перевищує 10%. У сірчистих мазутах, особливо продуктах крекінгу, утворюються ще більш стійкі емульсії. Для руйнування цих емульсій одним із найефективніших способів є додавання деемульгаторів[147].
Як фумігант |
Оксиран або його суміш з діоксидом вуглецю може застосовуватися як стерилізуючий агент, фумігант, засіб захисту від кліщів та інших комах.
У виробництві інших похідних |
Етиленціангідрин, який одержують з оксирану і синильної кислоти, є проміжним продуктом в одному з методів синтезу нітрилу акрилової кислоти, який широко застосовується у виробництві синтетичних волокон і кополімерних синтетичних каучуків.
В інших галузях |
Оксиран завдяки своїй надзвичайній хімічній активності вступає в реакції з численними сполуками різних класів, тому він застосовується для синтезу речовин, що використовуються у фармацевтичній промисловості, в препаративній хімії, в різних галузях промисловості.
Окрім того, оксиран використовується в деяких новітніх методах розділення пар хіральних ізомерів амінокислот[148] та як специфічне середовище для досліджень задопомогою ЯМР[149].
Фізіологічна дія |
Оксиран здійснює деякий токсичний вплив як у рідкому, так і в газоподібному стані. На його токсичність великий вплив мають вологість повітря і його температура[150]. Перші дослідження токсичності оксирану мали на меті встановити, наскільки він є наркотиком, оскільки його анестезуючі властивості подібні до дії ефіру і хлороформу. При дослідах на тваринах було встановлено, що крім наркотичної дії ця речовина отруйна і спричиняє ясно виражені наслідки[151]. Симптомами гострого отруєння собак, щурів і мишей випарами оксирану є тремтіння м'язів, м'язова атрофія і анемія, сльозотеча, важке дихання, нежить[152].
Гострий набряк легень
Отруєння оксираном при вдиханні характеризується двома стадіями: першою — суто наркотичною з помірним місцевим подразненням і другою, яка характеризується загальною дією на клітинну тканину. При концентрації випарів оксирану менше 1 мг/л, що відповідає вмісту 0,05 об'ємних %, через 3—4 години виявляється подразнення слизових оболонок носа і очей у тварин. При концентраціях більше 1 мг/л подразнююча дію проявляється набагато швидше і виражена сильніше. При концентрації 32 мг/л (1,6 об'ємних %) отруєння супроводжується сильним проносом. З певних концентрацій починає проявлятися запізніла післядія оксирану — через тижні або навіть через місяці.
Смерть собак і кішок настає внаслідок задухи, що супроводжується судомами і загальним паралічем. При розтинах виявлений сильний набряк легень, їх збільшених в об'ємі і масі. Мозкові оболонки багаті кров'ю, мозкові судини розширені. Крім того, спостерігається дегенеративне ожиріння серцевого м'яза, а також ожиріння печінки і нирок та застійні явища в них. Ця післядія є, ймовірно, результатом повільних перетворень оксирану в організмі, що призводять до утворення отруйних продуктів. До ймовірних продуктів такого перетворення відносяться альдегіди (ацетальдегід та інші). Відбувається також внутрішньоклітинне утворення етиленгліколю з наступним його окисненням до щавлевої кислоти.
Тривале вдихання повітря, що містить невеликі кількості оксирану, зазвичай небезпечніше від коротких вдихань цієї речовини у великих концентраціях.
У промисловості в більшості випадків людям доводиться зазнавати дії розбавлених випарів оксирану. Поріг сприйняття людиною запаху оксирану 1,26 мг/л[151]. Першими ознаками отруєння людини є подразнення слизових оболонок очей і носоглотки, кашель при вдиханні[153][154]. Високі концентрації оксирану в повітрі викликають набряк легень. Тривале вдихання невеликих кількостей оксирану навіть за відсутності подразнення слизових оболонок може призвести до непомітного поглинання людиною високотоксичних його концентрацій і до поступового розвинення глибокого системного отруєння. Вдихання оксирану у великих концентраціях негайно викликає подразнення дихальних шляхів і свідчить про наявність в повітрі небезпечних його кількостей[155].
Звичайні симптоми системного отруєння оксираном — головний біль, задишка, нудота і блювання, що триває до півтори доби[154]. Відзначались також пригнічений стан, сонливість, розумова стомлюваність, порушення координації і зміна складу крові (лімфоцитоз і лейкоцитоз)[156]. Після вдихання випарів оксирану протягом 1 хвилини починається легке серцебиття, посмикування м'язів, почервоніння обличчя, а потім головні болі і зниження слуху[157].
Після перебування людини в атмосфері, що містить випари оксирану, протягом 10 хвилин наступало сильне блювання, запаморочення і порушення серцевої діяльності протягом декількох тижнів. При отруєнні оксираном починаються також сильний пульсуючий головний біль, запаморочення, невпевненість при ходьбі, утруднення мови, розлад сну, болі в ногах, млявість і скованість[158]. Оксиран є протоплазматичною отрутою[159].
Рідкий оксиран при попаданні в око людини викликає опік рогівки, який при відповідній обробці проходить через два дні[160]. Після однохвилинної дії 50%-ного розчину оксирану на шкіру через 1—5 годин з'являються почервоніння, набряк, дрібні пухирі, які зникають через 6-12 годин[161]. При тривалій дії 1%-ного розчину оксирану спостерігались опіки другого ступеня. Через 6—12 годин після контакту з'являються великі пухирі, що супроводжувалися значним почервонінням, сверблячкою, виразками шкіри і болем.
Гранично допустима концентрація оксирану в повітрі прийнята рівною 1 мг/л[7].
Див. також |
| Вікісховище має мультимедійні дані за темою: Оксиран |
- Етилен
- Епоксипропан
- Етиленгліколь
- Діетиленгліколь
- Гліколі
- Полігліколі
Примітки |
↑ Ластухін Ю.О., Воронов С.А. Органічна хімія. — Львів, «Центр Європи», 2006. С. — 348-349.
↑ абвг Maas O., Boomer E., Journal of the American Chemical Society, 44, 1709 (1922). (англ.)
↑ Walden P., Zeitschrift für Physikalische Chemie, 70, 569 (1910). (нім.)
↑ Auwers K., Justus Liebigs Annalen der Chemie 415, 145 (1918). (нім.)
↑ Stuart H. A., Zeitschrift für Physik, 51, 490 (1928). (нім.)
↑ Berthelot М., Annales de chimie et de physique, 27, 347 (1882). (фр.)
↑ аб Лазарев H. В., Вредные вещества в промышленности, «Химия», ч. I, 1963, стр. 477. (рос.)
↑ Würtz A. Comptes rendus de l'Académie des sciences 1859, 48 p 101–104. (фр.)
↑ Würtz A., Annales de chimie et de physique, 55, 400 (1859). (фр.)
↑ Würtz A., Annales de chimie et de physique, 110, 125 (1859). (фр.)
↑ Würtz A., Annales de chimie et de physique, 116, 249 (1860). (фр.)
↑ Roithner E., Monatshefte für Chemie, 15, 665 (1894). (нім.)
↑ Bredig, Usoff, Electrochemistry, 3, 116 (1896). (англ.)
↑ Hantzsch, Hilbert, Berichte der Deutschen Chemischen Gesellschaft, 40, 1514 (1907). (нім.)
↑ Walkor, Berichte der Deutschen Chemischen Gesellschaft, 34, 4117 (1901). (нім.)
↑ Красуский Ж., Журнал Русского физико-химического общества, 32, 86 (1900). (рос.)
↑ Redgrove H. S., Chemistry News, 98, 2 (1908). (англ.)
↑ Ackermann P., Meyer J., Journal of Chemical Physics, 4, 377 (1936). (англ.)
↑ Bredig G., Usoff; Z. Electrochem., 3, 116 (1896).
↑ Курбатов В. Я., Журнал Русского химического общества, 43, 1946 (1911). (рос.)
↑ аб Giauque W. F., Gordon J., Journal of the American Chemical Society, 71, 2176 (1949). (англ.)
↑ Encyclopedia of Chemicai Technology, v. 5, New York, 1955, p. 906–925. (англ.)
↑ Hess L. G., Tilton V. V., Industrial & Engineering Chemistry Research, 42, № 6, 1251 (1950). (англ.)
↑ МалиновскийМ. С., Окиси олефинов и их производные, Госхимиздат, 1961. (рос.)
↑ Зимаков П. В., Окись этилена, Госхимиздат, 1946. (рос.)
↑ Hess L. G., Tilton V. V., Industrial & Engineering Chemistry Research, 42, № 6, 1251 (1950). (англ.)
↑ Horsley L. H., Analytical Chemistry, 19, 525 (1947).
↑ Патент США 2103849, 1937. (англ.)
↑ Німецький патент 299682, 1920. (нім.)
↑ Патент США 1446872, 1923. (англ.)
↑ Англійський патент 374864, 1931. (англ.)
↑ Патент США 1996638, 1934. (англ.)
↑ Німецький патент 299682, 1920. (нім.)
↑ Шенфельд Н., Неионогенные моющие средства, Издательство «Химия», 1965. (рос.)
↑ Lehners S., Journal of the Society of Chemical Industry, 53, 3737 (1931). (англ.)
↑ аб Bone W., Haffner M., Rance L., Proceedings of the Royal Society, 143А, 16 (1933).
↑ Англійський патент 924628, 1959. (англ.)
↑ Debereiner J., Annalen der Pharmacie, 2, 343 (1832). (нім.)
↑ Phillips F. C., Zeitschrift für anorganische und allgemeine Chemie, 6, 213 (1894). (нім.)
↑ Willstatter R., Bommer U. М., Justus Liebigs Annalen der Chemie, 422, 36 (1921). (нім.)
↑ Фраисои Д., Промышленный способ производства окиси этилена и этиленгликоля, в сб. «Окись этилена, этиленгликоли, этиленхлоргидрин», ОНТИ, 1935, стр. 50—61. (рос.)
↑ Патент України № 52630. Спосіб дистиляції етиленоксиду. (pdf). ДП «УІПВ». Процитовано 26.08.13.
↑ Патент України № 60382. Спосіб одержання етиленоксиду прямим окислюванням етилену повітрям або киснем. (pdf). ДП «УІПВ». Процитовано 26.08.13.
↑ Demol Е., Justus Liebigs Annalen der Chemie und Pharmacie, 173, 125 (1874).
↑ Шленк В., Бергман Э., Органическая химия, ОНТИ, 1936, стр. 213. (рос.)
↑ Dominik W., Bartkiewiezowna J., Przemysł Chemiczny, 18, 373 (1934). (пол.)
↑ Green H, Berichte der Deutschen Chemischen Gesellschaft, 12, 282 (1879). (нім.)
↑ Peytral Е., Bulletin de la Société Chimique de France France, 36, 206 (1926). (фр.)
↑ Heckert W., Meek E., Journal of the American Chemical Society, 51, 2706 (1929). (англ.)
↑ Phibbs M. K., Darwent B., Steacie E. W. R., Journal of Chemical Physics, 16, 39 (1948). (англ.)
↑ Cvetanovic R. I., Canadian Journal of Chemistry., 33, № 11, 1684 (1955). (англ.)
↑ Rice F. О., Polly О. L., Journal of Chemical Physics, 6, 273 (1936). (англ.)
↑ Wilson Е. М., Journal of the American Rocket Society, 23, № 6, 368 (1953). (англ.)
↑ Jones L. W., Kennedy R. E., Industrial & Engineering Chemistry, 22, № 2, 146 (1930). (англ.)
↑ Jones R. M., Industrial & Engineering Chemistry, 25, № 4, 394 (1933). (англ.)
↑ Burden F. A., Bourgoyne J. H., Proceedings of the Royal Society (London), A, 199 , 328 (1949). (англ.)
↑ Haenni E. 0., Affens W. A., Lento H. G., Industrial & Engineering Chemistry, 51, № 5, 685 (1951). (англ.)
↑ Burgoyne J. H., Burden F. A., Nature, 162, 181 (1948). (англ.)
↑ Burgoyne J. H., Burden F. A., Nature, 163, 723 (1949) (англ.).
↑ Würtz A., Annales de chimie et de physique, (3), 69, 317, 355 (1863) (фр.).
↑ Меншуткин H., Лекции no органической химии, С-Петербург, 1897, стр. 270. (рос.)
↑ Würtz A., Annales de chimie et de physique, (3), 69, 317, 355 (1863). (фр.)
↑ Linnemann E., Monatshefte für Chemie, 6, 369 (1865). (нім.)
↑ Scott С., The Journal of Organic Chemistry, 22, 1118 (1957). (англ.)
↑ Каширский М., Журнал Русского физико-химического общества, 13, 76 (1881). (рос.)
↑ Ипатьев В. Н., Леонтович В., Chemische Berichte, 36, 2016 (1903). (нім.)
↑ Nef I., Liebigs Annalen, 335, 197 (1904). (нім.)
↑ Юрьев Ю. К., Новицкий К. Ю., Доклады Академии наук СССР, 63, 285 (1948). (рос.)
↑ Twigg G. H., Transactions of the Faraday Society, 42, 284, 657 (1946). (англ.)
↑ Twigg G. H., Proceedings of the Royal Society (London), 188A, 92 (1946). (англ.)
↑ аб Baize Т. Н., Industrial & Engineering Chemistry, 53, № 11, 903 (1961). (англ.)
↑ Staudinger H., Schveitier О., Chemische Berichte, 62 , 2395 (1925). (нім.)
↑ аб Штаудингер Г., Высокомолекулярные органические соединения, ОНТИ, 1935, стр. 285–333. (рос.)
↑ Freudenberg Н., Liebigs Annalen, 433, 230 (1923). (нім.)
↑ Bronsted I. Н., Kilpatrick М., Kilpatrick М., Journal of the American Chemical Society, 51, 428 (1929). (англ.)
↑ Henry М., Comptes Rendus de l'Académie des Sciences, 144, 1404 (1907). (фр.)
↑ аб Carihell R. K., Galloway I. R., Olsen R. W., Smith I. М., Industrial & Engineering Chemistry, 40, 389 (1948). (англ.)
↑ Jones I. L., Journal of the American Chemical Society, 61, 527 (1939). (англ.)
↑ Патент США 1998003, 1933. (англ.)
↑ Німецький патент 578722, 1933. (нім.)
↑ Патент США 1614883, 1927. (англ.)
↑ Німецький патент 626491, 1936. (нім.)
↑ Англійський патент 439880, 1935. (англ.)
↑ Англійський патент 415382, 1934. (англ.)
↑ Hantzsch A., Hilbert H., Chemische Berichte, 40, 1514 (1907). (нім.)
↑ Paterno E., Oliveri V., Gazzetta Chimica Italiana, 24 (1), 305 (1894). (італ.)
↑ Swartz F., Bulletin de l'Académie Royale de Belgique, 7, 17 (1914). (фр.)
↑ Французький патент 806632, 1936. (фр.)
↑ Würtz A., Annales de chimie et de physique, 110, 125 (1859). (нім.)
↑ Hanziot М., Bulletin de la Société Chimique de France, (2), 32, 551 (1879). (фр.)
↑ Малиновский М. С., Журнал общей химии, 10, 1918 (1940). (рос.)
↑ Малиновский М. С., Романцеввч М. К., в кн. «Сборник статей по общей химии», т. 2, Изд. АН СССР, 1953, стр. 13. (рос.)
↑ Würtz A., Annales de chimie et de physique, 113, 255 (1860). (нім.)
↑ аб Англійський патент 354357, 1941. (англ.)
↑ Knoevenagel E., Justus Liebigs Annalen der Chemie, 402, 111 (1914). (нім.)
↑ Англійський патент 670153. (англ.)
↑ Патент США 2686148, 1951. (англ.)
↑ Англійський патент 500300, 1937. (англ.)
↑ Французький патент 837626, 1938. (фр.)
↑ Würtz A., Annales de chimie et de physique, 114, 5 (1860). (нім.)
↑ Knorr L., Berichte der Deutschen Chemischen Gesellschaft, 32, 729 (1899). (нім.)
↑ Fischer E. I., Allgemeine oel- und Fett-Zeitung, 32, 489 (1935). (нім.)
↑ Дубянский П., Журнал органической химии, 2, 571 (1936). (рос.)
↑ Эллис К., Химия углеводородов нефти и их производных, т. 1, ОНТИ, 1936, стр. 1598. (нім.)
↑ Ruberg L., Shriner R., Journal of the American Chemical Society, 57, 1581 (1935). (англ.)
↑ Goldberg S. D., Whitmore W. E., Journal of the American Chemical Society, 59, 2280 (1937). (англ.)
↑ Патент США 1965008, 1934. (англ.)
↑ Патент ФРН 1020983, 1958. (нім.)
↑ Англійський патент 801710, 1958. (англ.)
↑ Патент США 2773070, 1952. (англ.)
↑ Патент США 2667497, 1954. (англ.)
↑ Fromm Е., Jorg Н., Berichte der Deutschen Chemischen Gesellschaft, 58, 304 (1925). (нім.)
↑ Французький патент 769216, 1933. (фр.)
↑ Nenitzescu С. D., Scarlatescu W., Berichte der Deutschen Chemischen Gesellschaft, 68, 587 (1935). (нім.)
↑ Othmer D. F., Kern D., Industrial & Engineering Chemistry, 32, 160 (1940). (англ.)
↑ Иоффе Д. В., Рачинский Д. Ю., Успехи химии, 26, 678 (1957). (рос.)
↑ Danehy I. P., Vogt R., Newland I., Journal of the American Chemical Society, 56, 2790 (1934) (англ.).
↑ Faucouneau, Chemical Reviews, 199, 605 (1934). (англ.)
↑ Erlenmeyer E., Justus Liebigs Annalen der Chemie, 191, 269 (1878). (нім.)
↑ Німецький патент 496372, 1925. (нім.)
↑ Патент США 1388018, 1921. (англ.)
↑ Schaarschmidt A., Hermann L., Szemso В., Chemische Berichte, 58, 1914 (1925). (нім.)
↑ аб Канадський патент 340555, 1934. (англ.)
↑ Kulkotta W., Tinker I., Journal of the American Chemical Society, 60, 986 (1938). (англ.)
↑ Adams М., Calvin A., Journal of the American Chemical Society, 72, 4368 (1950). (англ.)
↑ Wurtz A., Annales de chimie et de physique, 116, 252 (1860). (фр.)
↑ Deckert W., Angewandte Chemie, 45, 559 (1932). (нім.)
↑ Lenher S., Journal of the American Chemical Society, 53, 3737, 3752 (1931). (англ.)
↑ Levin G., Paint Manufacturer, 24, 434 (1954). (англ.)
↑ Deckert W., Zeitschrift für Analytische Chemie, 82, 297 (1930). (нім.)
↑ Mousseron М., Jullien J., Peyron A., Parfums, cosmetic savons, 13, 3 (1958). (англ.)
↑ Swan J. D., Analytical Chemistry, 26, 878 (1954). (англ.)
↑ Foucry E., Peintures, Pigments, Vernis, 30, 925 (1954). (англ.)
↑ аб Deckert W., Zeitschrift für Analytische Chemie, 82, 297 (1930). (нім.)
↑ Lubatti O. F., Journal of the Society of Chemical Industry, 51, 361T (1932). (нім.)
↑ аб Kerckow F. W., Zeitschrift für Analytische Chemie, 108, 249 (1937). (нім.)
↑ Müller A., Chemiker Zeitung, 44, 513 (1920). (нім.)
↑ Eastham A. М., Latremouille G. A., The Canadian Journal of Research, 28B, 264 (1950). (англ.)
↑ Critchfield F. Е., Johnson J. В., Analytical Chemistry, 29, 797 (1957). (англ.)
↑ Amberg C. H., Echigoya E., Kulawic D., Canadian Journal of Chemistry, 37, 708 (1959). (англ.)
↑ Взрывчатые вещества, Сборник переводных статей, ОНТИ, 1934. (рос.)
↑ Будников М. А. и др., Взрывчатые вещества и пороха, Оборонгиз, 1955. (рос.)
↑ Деклараційний патент на корисну модель № 67756. Спосіб приготування лакофарбових матеріалів для отримання водорозчинного покриття на основі поліетиленоксиду. (pdf). ДП «УІПВ». Процитовано 26.08.13.
↑ Деклараційний патент на винахід № 31614 A. Композиція на основі поліетиленоксиду /варіанти/. (pdf). ДП «УІПВ». Процитовано 25.08.13.
↑ Деклараційний патент на винахід № 67758. Спосіб приготування швидкорозчинного поліетиленоксиду. (pdf). ДП «УІПВ». Процитовано 26.08.13.
↑ Неволин Ф., Синтетические моющие средства, Пищепромиздат, 1957. (рос.)
↑ Технология переработки нефти и газа. Ч. 3-я. Черножуков Н. И. Очистка и разделение нефтяного сыръя, производство товарных нефтепродуктов. – Москва: «Химия», 1978. С. 336. (рос.)
↑ En-Ping Lina, Kai-Cheng Linb, Chia-Wei Changa, Ming-Mu Hsieh. On-line sample preconcentration by sweeping and poly(ethylene oxide)-mediated stacking for simultaneous analysis of nine pairs of amino acid enantiomers in capillary electrophoresis. Talanta 114, (30) 2013, pp. 297–303.
↑ Christian Merle1,
Dr. Grit Kummerlöwe, Dr. J. Christoph Freudenberger, Dr. Felix Halbach, Wolfgang Stöwer, Dr. Christoph Lierse v. Gostomski, Dr. Johannes Höpfner, Timo Beskers, Prof. Dr. Manfred Wilhelm, Prof. Dr. Burkhard Luy. Crosslinked Poly(ethylene oxide) as a Versatile Alignment Medium for the Measurement of Residual Anisotropic NMR Parameters. Angewandte Chemie International Edition 1-2, 2013, pp. 1-5.
↑ Sudendorf Th., Kröger Е., Chemiker Zeitung, 55, № 57, 549 (1931). (нім.)
↑ аб Zernik F., Gasmaske, 1—6, 3 (1933). (нім.)
↑ Jacobson K. H., Hackley E. B., Feinsilver L., Archives of Industrial Health, 13, № 3, 237 (1956). (англ.)
↑ Hollingsworth R. L., Rowe V. К., Oyen F. et al., Archives of Industrial Health, 13, № 3, 217 (1956). (англ.)
↑ аб Von Oettingen W., Occupation and Health Supplement, October, 1939. (англ.)
↑ Waite С. P., Patty F. A., Vant W. P., United States Public Health Reports, 45, 1832 (1930). (англ.)
↑ Sexton R. I., Archives of Industrial Hygiene and Occupational Medicine, 2, № 5, 549 (1950). (англ.)
↑ Tilling W., Arzneimittel-Forschung, 169, № 3—4, 216 (1954). (нім.)
↑ Бонгард Э. М., Шляпин В. Ф., Гигиена труда и профессиональных заболеваний, № 2, 9 (1960). (рос.)
↑ Carozzi L., Folia Medica (Naples), 33, 97 (1950). (італ.)
↑ McLaughlin R. S., American Journal of Ophthalmology, 29, 1355 (1946). (англ.)
↑ Соринсон H. С., Вестник дерматологии и венерологии, № 1, 5, 64 (1958). (рос.)
Джерела |
- Ластухін Ю.О., Воронов С.А. Органічна хімія. — Видання третє. — Львів : Центр Європи, 2006. — С. 348-356. — ISBN 966-7022-19-6.
- Бесслінг Б., Цекк С., Плюккхан Ю., Майєр Т., Льоффлер У., Шпігель Г., Балленвег Р., Бруді Г., Гізельберг К., Хільпрехт Л., Тер'юнг В., Ауер Х., Польт А., Шолль Ш. Патент України № 52630. Спосіб дистиляції етиленоксиду.
- Тайз Г., Вансант Ф. Патент України № 60382. Спосіб одержання етиленоксиду прямим окислюванням етилену повітрям або киснем.
- Ступін О. Б., Симоненко О. П., Сердюк О. І., Фоменко С. О. Деклараційний патент на корисну модель № 67756. Спосіб приготування лакофарбових матеріалів для отримання водорозчинного покриття на основі поліетиленоксиду.
- Посудієвський О. Ю., Курись Я. І., Походенко В. Д. Деклараційний патент на винахід № 31614 A. Композиція на основі поліетиленоксиду /варіанти/.
- Ступін О. Б., Симоненко О. П., Сердюк О. І., Собко О. Ю. Деклараційний патент на винахід № 67758. Спосіб приготування швидкорозчинного поліетиленоксиду.
Зимаков П.В., Дымент О.Н., Богословский Н.А. Окись этилена. — Москва : Химия, 1967. — 320 с. (рос.)
Дрюк В.Г., Карцев В.Г., Войцеховская М.А. Оксираны — синтез и биологическая активность. — Москва : Богородский печатник, 1999. — 999 прим. — ISBN 5-89589-008-3. (рос.)
Дымент О.Н., Казанский К.С., Мирошников А.М. Гликоли и другие производные окисей этилена и пропилена. — Москва : Химия, 1976. — 376 с. (рос.)
Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Ленинград : Химия, 1976. — Т. 1. — С. 475-478. — 49000 прим. (рос.)
Нуртдинов С. Х., Николаев В. Ф., Султанова Р. Б., Фахрутдинова Р. А. Оксид этилена и его производные. — Калининград : КГТУ, 2007. — 90 с. — ISBN 9785788204598. (рос.)
Ethylene Oxide. — Environment Canada, 2001. — 82 с. — ISBN 9780662289807. (англ.)
Посилання |
Ткаченко О. В. Фармацевтична енциклопедія.
Державний класифікатор продукції та послуг.
Ранський А. П. Органічна хімія і екологія.
Сертифікат безпечності оксирану. (англ.)
Національний інститут з охорони праці та здоров'я. (англ.)
Виробництво оксирану. (англ.)
| ||||||||||||||||||||
| Ця стаття належить до добрих статей української Вікіпедії. |







![mathrmCH_2(O)CH_2 xrightarrow[-H_2O] HCequivCH xrightarrow+H_2 H_2C=CH_2](https://wikimedia.org/api/rest_v1/media/math/render/svg/0960c96146edb4f3a1f7d34c15a836ac2554d9a1)




![mathrmCH_2(O)CH_2 xrightarrow[H_2O]AgNO_3 HOOC-CH_2OH](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d7bbf8c5f597975d7f63a070af73b10323f4432)