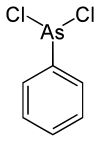
Фенілдихлороарсин
| Фенілдихлороарсин | |
|---|---|
 | |
 | |
| Інші назви | PD |
| Ідентифікатори | |
| Номер CAS | 696-28-6 |
| Номер EINECS | 211-791-9 |
| RTECS | CH5425000 |
| SMILES | C1=CC=C(C=C1)[As](Cl)Cl[1] |
| InChI | 1S/C6H5AsCl2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
| Властивості | |
Молекулярна формула | C6H5AsCl2 |
Молярна маса | 222,932 г/моль |
| Зовнішній вигляд | безбарвна рідина |
Густина | 1,6516 г/см³ (20 °C) |
Тпл | -19 °C |
Ткип | 255 °C |
Показник заломлення (nD) | 1,6386 (15 °C) |
| Якщо не зазначено інше, дані приведені для речовин у стандартному стані (за 25 °C, 100 кПа) | |
Інструкція з використання шаблону | |
Примітки картки | |
Фенілдихлороарсин — арсенорганічна сполука складу C6H5AsCl2. Має токсичну дію на шкіру та органи дихання. У період Першої світової війни застосовувався у поєднанні з отруйними речовинами шкірно-наривної дії та подразнювальної дії. У контексті військового застосування має позначення PD.
Зміст
1 Історія
2 Фізичні властивості
3 Отримання
4 Хімічні властивості
5 Токсичність
6 Примітки
7 Джерела
Історія |
Фнілдихлороарсин був синтезований у 1878 році В. Ла Костом та А. Міхаелісом.[2]
Завдяки своїм токсичним властивостям вже у вересні 1917 року він був застосований на полі бою силами Німеччини. В хімічному арсеналі Німеччини він відігравав роль розчинника для дифенілхлороарсину та дифенілціаноарсину і був класифікований як компонент сумішей типу «синій хрест», а з боку сил Франції його суміш з дифенілхлороарсином мала назву «стерніт».
У часи Другої світової фенілдихлороарсин входив до складу німецьких та італійських бойових іпритних сумішей, що використовувалися у зимовий період (нім. Winterlost).
Фізичні властивості |
Фенілдихлороарсин є найстійкішим представником у ряді алкіларсинових отруйних речовин. Він нерозчинний у воді, проте добре розчиняється в органічних розчинниках.
Леткість фенілдихлороарсину становить 390 мг/м³ за 25 °C.
Отримання |
Історично першим способом синтезу фенілдихлороарсину була реакція між бензеном та трихлоридом арсену, які пропускалися крізь розігріту трубку:
- C6H6+AsCl3⟶C6H5AsCl2+HCldisplaystyle mathrm C_6H_6+AsCl_3longrightarrow C_6H_5AsCl_2+HCl
Отриманий у такий спосіб продукт мав значну кількість домішкового дифенілу і з деякими труднощами міг бути очищений перегонкою або перекристалізацією. Пізніше відкривачі цієї сполуки, Ла Кост і Міхаеліс, запропонували ефективніший метод — нагрівання дифенілртуті до 250 °C із надлишком трихлориду арсену:
- (C6H5)2Hg+2AsCl3 →250oC 2C6H5AsCl2+HgCl2displaystyle mathrm (C_6H_5)_2Hg+2AsCl_3 xrightarrow 250^oC 2C_6H_5AsCl_2+HgCl_2
Іншим методом, розробленим у 1914 році, є нагрівання у закритій ємності протягом 30 годин і за температури 250 °C суміші трифеніларсину і трихлориду арсену:
- (C6H5)3As+2AsCl3 →250oC 3C6H5AsCl2displaystyle mathrm (C_6H_5)_3As+2AsCl_3 xrightarrow 250^oC 3C_6H_5AsCl_2
Хімічні властивості |

Будова феніларсиноксиду
Аналогічно до інших алкільних похідних арсину, фенілдихлороарсин легко гідролізується, утворюючи феніларсиноксид. Ця сполука кристалізується у формі тетрамеру.
- C6H5AsCl2+H2O⟶C6H5AsO+2HCldisplaystyle mathrm C_6H_5AsCl_2+H_2Olongrightarrow C_6H_5AsO+2HCl
При дії лугів він так само розкладається до феніларсиноксиду, однак у присутності надлишкової кількості лугів з нього утворюються солі феніларсенітної кислоти:
- C6H5AsCl2+2NaOH⟶C6H5As(ONa)2+H2Odisplaystyle mathrm C_6H_5AsCl_2+2NaOHlongrightarrow C_6H_5As(ONa)_2+H_2O
Фенілдихлороарсин здатен хлоруватися до фенілтетрахлороарсину, котрий є нестійким і розкладається до феніларсенатної кислоти у присутності вологи:
- C6H5AsCl2+Cl2⟶C6H5AsCl4displaystyle mathrm C_6H_5AsCl_2+Cl_2longrightarrow C_6H_5AsCl_4
- C6H5AsCl4+3H2O⟶(C6H5)H2AsO3+4HCldisplaystyle mathrm C_6H_5AsCl_4+3H_2Olongrightarrow (C_6H_5)H_2AsO_3+4HCl
У бензеновому розчині фенілдихлороарсин взаємодіє з аміаком, утворюючи імін:
- C6H5AsCl2+3NH3⟶C6H5As=NH+2NH4Cldisplaystyle mathrm C_6H_5AsCl_2+3NH_3longrightarrow C_6H_5As=NH+2NH_4Cl
У спортовому розчині із сірководнем утворюється сульфід. Ця реакція є дуже чутливою і дозволяє визначати фенілдихлороарсин у концентрації 0,05 г/л.
- C6H5AsCl2+H2S⟶C6H5AsS+2HCldisplaystyle mathrm C_6H_5AsCl_2+H_2Slongrightarrow C_6H_5AsS+2HCl
При взаємодії з ацилхлоридами у розчині сірковуглецю та у присутності хлориду алюмінію утворюються відповідні кетони та хлорид арсену:
- C6H5AsCl2+CH3COCl⟶CH3C(O)C6H5+AsCl3displaystyle mathrm C_6H_5AsCl_2+CH_3COCllongrightarrow CH_3C(O)C_6H_5+AsCl_3
Токсичність |
Фенілдихлороарсин виявляє дію отруйної речовини шкірно-наривної дії, а також має властивості стерніту, подразнюючи дихальні шляхи і спричинюючи блювоту. Подразнення при вдиханні отруєного повітря спричинює дія речовини концентрацією 16 мг-хв/м³, а напівлетальна концентрація знаходиться на рівні 2,600 мг-хв/м³.
Ураження очей при його присутності у повітрі відбувається миттєво, а результат впливу на шкіру проявляється із затримкою у 30—60 хвилин. При цьому його ефект на органи зору на 30 % слабший за ефект від іприту, а на шкіру — на 10 %.
Примітки |
↑ Dichlorophenylarsined:Track:Q278487
↑ La Coste, W., Michaelis A. Ueber Mono- und Diphenylarsenverbindungen // Chemische Berichte. — 1878. — Т. 11, вип. 2 (18 квітня). — С. 1883—1887. — DOI:. (нім.)
Джерела |
Hoenig, S. L. Compendium of Chemical Warfare Agents. — New York : Springer, 2007. — 222 p. — ISBN 0-387-34626-0. (англ.)
CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
Medical Aspects of Chemical Warfare / Martha K. Lenhart, editor in chief. — Washington DC : Office of The Surgeon General, United States Army, 2008. — P. 38. — ISBN 978-0-16-081532-4. (англ.)
Sartori, M. The War Gases. — New York : Van Nostrand, 1939. — 360 p. (англ.)
Франке З. Химия отравляющих веществ. — М. : Химия, 1973. — Т. 1. — 440 с. (рос.)
| ||||||||||||||||||||||||||||||||||||||
Це незавершена стаття про зброю. Ви можете допомогти проекту, виправивши або дописавши її. |
Це незавершена стаття про органічну сполуку. Ви можете допомогти проекту, виправивши або дописавши її. |









