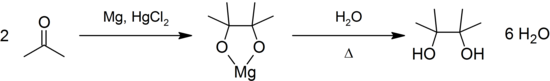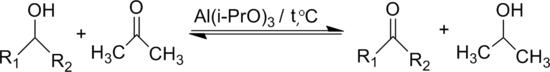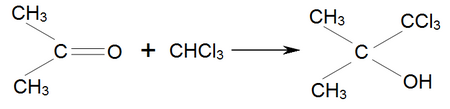Ацетон
| Ацетон | |
|---|---|
 |  |
 | |
Назва за IUPAC | пропанон |
| Інші назви | диметилкетон, 2-пропанон, пропан-2-он |
| Ідентифікатори | |
| Номер CAS | 67-64-1 |
| PubChem | 180 |
| Номер EINECS | 200-662-2 |
| Номер EC | 200-662-2 |
| KEGG | D02311 |
| Назва MeSH | Acetone |
| ChEBI | CHEBI:15347 |
| RTECS | AL3150000 |
| SMILES | CC(C)=O |
| InChI | 1S/C3H6O/c1-3(2)4/h1-2H3 |
| Номер Бельштейна | 635680 |
| Номер Гмеліна | 1466 |
| Властивості | |
Молекулярна формула | С3Н6O |
Молярна маса | 58,079 г/моль |
Молекулярна маса | 58 а. о. м. |
| Зовнішній вигляд | Летка безбарвна рідина |
Запах | Характерний |
Густина | 0,79705 г/см³ (15 °C) |
Тпл | −94,9 °C |
Ткип | 56,5 °C |
Тиск насиченої пари | 179,63 мм рт. ст. (при 20 °С) |
Кислотність (pKa) | 24,2 |
Основність (pKb) | -10,2 |
Діелектрична проникність (ε) | 21,4 |
Показник заломлення (nD) | 1,35998 |
В'язкість | 0,36 мПа·с (при 10 °С) |
Дипольний момент | 2,80 |
| Термохімія | |
Ст. ентальпія утворення ΔfH | -248,4 кДж/моль (рід.) -217,1 кДж/моль (газ)[1] |
Ст. ентальпія згоряння ΔcH | -1787 кДж/моль (рід.)[2] |
Ст. ентропія S | 199,8 Дж/(моль·K) (рід.) 295,3 Дж/(моль·K) (газ)[1] |
Теплоємність, c | 126,3 Дж/(кмоль·К) (рід.) 74,5 Дж/(моль·K) (газ)[1] |
| Небезпеки | |
ГДК (Україна) | 200 мг/м3 |
ЛД50 | 3000 мг/кг (миші, орально) |
| Індекс ЄС | 606-001-00-8 |
Класифікація ЄС | |
NFPA 704 |  3 1 0 |
Температура спалаху | −17 °C |
Температура самозаймання | 500 °C |
Вибухові границі | 2,15%-13,00% |
| Пов'язані речовини | |
| Пов'язані речовини | Бутанон, Ізопропіловий спирт |
| Якщо не зазначено інше, дані приведені для речовин у стандартному стані (за 25 °C, 100 кПа) | |
Інструкція з використання шаблону | |
Примітки картки | |
Ацето́н, пропано́н (від лат. acetum — оцет) — перший представник гомологічного ряду аліфатичних кетонів. Формула (CH3)2CO.
Зміст
1 Загальна характеристика
2 Промислове значення
3 Одержання
3.1 Старі методи
3.2 Одержання з ізопропілового спирту
3.3 Метод прямого окиснення пропілену
3.4 Кумол-гідропероксидний спосіб
3.5 Інші методи
4 Хімічні властивості
4.1 Окисно-відновні реакції
4.2 Приєднання нуклеофілів до карбонільної групи
4.3 Реакції по α-позиції
4.4 Реакції конденсації
4.5 Інші реакції
5 Застосування
6 Патофізіологічний вплив
6.1 Загальний характер дії
6.2 Вплив на тварин
6.3 Вплив на людину
6.4 Дія на шкіру
6.5 Потрапляння в організм та поведінка в ньому
6.6 «Аналіз на ацетон»
7 Див. також
8 Примітки
9 Джерела
10 Посилання
Загальна характеристика |
Безбарвна летка рідина з характерним запахом. Необмежено змішується з водою та полярними органічними розчинниками, також в обмежених пропорціях змішується з неполярними розчинниками.
Ацетон є цінним промисловим розчинником і завдяки невеликій токсичності він отримав широке застосування при виробництві лаків, вибухових речовин, лікарських засобів. Він є вихідною сировиною в численних хімічних синтезах. В лабораторній практиці його застосовують як полярний апротонний розчинник, для приготування охолоджувальних сумішей разом із сухим льодом і аміаком, ацетон є дуже корисним для миття хімічного посуду.
Ацетон є одним з продуктів метаболізму у живих організмах, зокрема, у людини. Він є одним із компонентів так званих ацетонових тіл, яких в крові здорової людини міститься вкрай мало, однак при патологічних станах (тривале голодування, важке фізичне навантаження, важка форма цукрового діабету) їх концентрація може значно підвищуватися і досягати 20 ммоль/л (кетонемія)[3].
В Україні ацетон, відповідно до Постанови Кабінету Міністрів від 5 грудня 2012 р. N 1129 «Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів», є прекурсором, стосовно якого встановлюються заходи контролю. Крім того таким же заходам контролю підлягають речовини, що містять не менш як 50% ацетону[4].
Промислове значення |

Андреас Лібавій — першовідкривач ацетону
Ацетон, один з найпростіших і найважливіших кетонів, вперше виявлений у 1595 році німецьким хіміком Андреасом Лібавієм при сухій перегонці ацетату свинцю. Але лише в 1832 році Жан-Батист Дюма і Юстус фон Лібіх точно визначили його природу і склад. До 1914 року ацетон отримували майже виключно шляхом коксування деревини, але підвищений попит на нього під час першої світової війни дуже швидко призвів до створення нових методів виробництва.
Одержання |
Старі методи |
Найстаріший метод промислового виробництва ацетону полягав у сухій перегонці ацетату кальцію, який утворюється при нейтралізації вапном деревного оцту, який утворюється при коксуванні деревини[5]. Зараз цей метод вже не застосовується, оскільки ацетон в цьому випадку містить занадто багато домішок, а вихідний матеріал дефіцитний.
Відомі також способи одержання ацетону шляхом бактеріального розщеплення вуглеводів (крохмалю, цукрів, меляси), причому як побічні продукти утворюються бутиловий або етиловий спирт[6][7][8]. Ацетон і бутиловий спирт одержують в мольному співвідношенні від 2:1 до 3:1.
- 2C6H12O6⟶CH3COCH3+CH3(CH2)3OH+5CO2+4H2displaystyle mathrm 2C_6H_12O_6longrightarrow CH_3COCH_3+CH_3(CH_2)_3OH+5CO_2+4H_2
У Німеччині був розроблений технологічний процес виробництва ацетону на основі оцтової кислоти[9]. При 400 °С через контакти з церію пропускали оцтову кислоту:
- 2CH3COOH→400oC, Ce CH3COCH3+CO2+H2Odisplaystyle mathrm 2CH_3COOHxrightarrow 400^oC, Ce CH_3COCH_3+CO_2+H_2O
Такий ацетон вирізняється особливою чистотою.
Ацетон також виробляють з ацетилену прямим синтезом:
- 2CH≡CH+3H2O⟶CH3COCH3+CO2+2H2displaystyle mathrm 2CHequiv CH+3H_2Olongrightarrow CH_3COCH_3+CO_2+2H_2
Ацетилен вступає у взаємодію з водяною парою при 450 °С в присутності каталізаторів (зокрема оксиду цинку або композиту Fe2O3-ZnO)[10][11][12][13].
Одержання з ізопропілового спирту |
Одним із головних методів одержання ацетону є дегідрогенізація ізопропілового спирту[14][15][16]:
- CH3CH(OH)CH3⟶CH3COCH3+H2displaystyle mathrm CH_3CH(OH)CH_3longrightarrow CH_3COCH_3+H_2
Дегідрогенізація протікає при 350—400 °С в присутності таких каталізаторів, як сплав залізо-мідь-цинк[17], оксид цинку або оксид цинку з 4,5% карбонату натрію[18], мідь, свинець та інші[19][20]. Внаслідок ендотермічного характеру реакції процес ведуть в трубчастому реакторі, вузькі довгі трубки якого обігріваються димовими газами. Продуктивність процесу зростає при підвищенні тиску (близько 2,7—3,4 атмосфери).
Активність каталізатора поступово знижується через відкладення на його поверхні сажі і смолистих речовин. Регенерація каталізатора полягає у випалюванні вуглецевих відкладень киснем, розбавленим інертними газами.
Останнім часом все частіше ацетон одержують шляхом окиснення ізопропілового спирту повітрям. При цьому також утворюється перекис водню:
- CH3CH(OH)CH3+O2⟶CH3COCH3+H2O2displaystyle mathrm CH_3CH(OH)CH_3+O_2longrightarrow CH_3COCH_3+H_2O_2
Цей метод відіграє певну роль при виробництві гліцерину за відсутності хлору. Як каталізатор при проведенні процесу застосовують срібло, мідь, нікель, платину та інші.
В цьому процесі повітря, насичене парами ізопропілового спирту, пропускається над тонким шаром каталізатора при температурі 400–650 °C. Продукти реакції швидко охолоджують, і конденсат після нейтралізації невеликих кількостей оцтової кислоти дистилюють. Виділений технічний ацетон ректифікують, а непрореагований ізопропіловий спирт повертають на окиснення.
Реакція окиснення ізопропілового спирту сильно екзотермічна і її важко контролювати. Тому рекомендується в одній реакції об'єднувати і окиснення, і дегідрогенізацію, для того щоб сумарний тепловий ефект наближався до нуля.
Метод прямого окиснення пропілену |

Ацетон
Розроблена і впроваджена в промисловості технологія прямого синтезу ацетальдегіду з етилену[21][22][23]
- CH2CH2+PdCl2+H2O⟶CH3CHO+Pd+2HCldisplaystyle mathrm CH_2CH_2+PdCl_2+H_2Olongrightarrow CH_3CHO+Pd+2HCl
може також служити для безпосереднього одержання ацетону з пропілену. У цьому випадку пропілен (або багата пропіленом суміш газів) під дією розчину каталізатору PdCl2 і CuCl2 в хлоридній кислоті перетворюється в ацетон. Відновлений каталізатор знову окислюється повітрям. При цьому протікають наступні реакції:
- CH2CHCH3+PdCl2+H2O⟶CH3COCH3+Pd+2HCldisplaystyle mathrm CH_2CHCH_3+PdCl_2+H_2Olongrightarrow CH_3COCH_3+Pd+2HCl
- 2CuCl2+Pd→H2O 2CuCl+PdCl2displaystyle mathrm 2CuCl_2+Pdxrightarrow H_2O 2CuCl+PdCl_2
- 2CuCl+2HCl+1/2O2⟶2CuCl2+H2Odisplaystyle mathrm 2CuCl+2HCl+1/2O_2longrightarrow 2CuCl_2+H_2O
Вихід становить 92—94% при 90—120 °С і тиску 9—12 кгс/см². Як побічні продукти утворюються 0,5—1,5% пропіонового альдегіду (пропаналю) і ~2% моно- і дихлороацетонів. Припускають, що реакція йде через комплекс [PdCl2(OH)C3H6]-, який у присутності води гідролітично розщеплюється на ацетон, паладій і хлоридну кислоту[24]. Агентами повторного окислення будуть CuCl2 або FeCl3, а також суміші обох сполук[25].
Реакцію можна проводити при кімнатній температурі, але підвищені температури прискорюють процес. У більшості випадків рН розчину становить від 3 до 4. Тиск також сприятливо впливає на хід реакції. Зазвичай працюють з дуже розведеним розчином PdCl2 (частково разом з ацетатом міді)[26]. Використання концентрованого розчину PdCl2 прискорює реакцію.
Модифіковані каталізатори акролеїну застосовуються і при прямому окисненні пропілену в ацетон. Каталізатори на основі MoO3 або Bi2O3 у присутності H3PO4 або H3BO3 при 375 °С дають поряд з ацетальдегідом, оцтовою кислотою, формальдегідом, етилацетатом і акролеїном також і ацетон[27], причому позитивного впливу надає додавання срібла[28]. Можна використовувати фосфоромолібдат бісмуту на Al2O3 та фосфоромолібденову кислоту на SiO2 (260 °С, 1 с)[29].
Кумол-гідропероксидний спосіб |
Цей спосіб також є одним з основних промислових способів одержання ацетону, він на 40% дешевший від методу одержання ацетону з ізопропілового спирту. Вихідними продуктами служать бензен і пропілен.
Алкілування бензену пропіленом здійснюють у присутності каталізатору хлориду алюмінію при температурі 50 °С. Як каталізатори використовували також концентровану сульфатну кислоту, фтороводень, флуорид бору та інші.
- C6H6+CH3−CH=CH2⟶C6H5CH(CH3)2displaystyle mathrm C_6H_6+CH_3-CH=CH_2longrightarrow C_6H_5CH(CH_3)_2
Окиснення кумолу проводиться киснем повітря при 4—5 атмосферах і 110—120 °С, при цьому утворюється гідропероксид кумолу.
- C6H5CH(CH3)2+O2⟶C6H5C(CH3)2OOHdisplaystyle mathrm C_6H_5CH(CH_3)_2+O_2longrightarrow C_6H_5C(CH_3)_2OOH
Гідропероксид кумолу при температурі 30—60 °С в присутності приблизно 0,1% сульфатної кислоти розкладається на фенол і ацетон:
- C6H5C(CH3)2OOH→H2SO4C6H5OH+CH3COCH3displaystyle mathrm C_6H_5C(CH_3)_2OOHxrightarrow H_2SO_4C_6H_5OH+CH_3COCH_3
Інші методи |

Оксид алюмінію — поширений каталізатор
Ацетон можна добути каталітичним розкладом парів оцтової кислоти при підвищеній температурі (400—450 °С). Каталізатори — карбонат кальцію або барію, оксиди кальцію, алюмінію, торію, урану, цинку, солі марганцю та інші.
- 2CH3COOH+O2⟶CH3COCH3+CO2+H2Odisplaystyle mathrm 2CH_3COOH+O_2longrightarrow CH_3COCH_3+CO_2+H_2O
Іншим відомим методом є каталітична дегідрогенізація парів етанолу при температурі 450—500 °С. Каталізаторами процесу є оксид заліза, активоване вапно та інші.
- C2H5OH⟶CH3COH+H2displaystyle mathrm C_2H_5OHlongrightarrow CH_3COH+H_2
Можливе утворення ацетону при каталітичному окисненні пропану киснем повітря при температурі 400 °C:
- C3H8+O2⟶CH3COCH3+H2Odisplaystyle mathrm C_3H_8+O_2longrightarrow CH_3COCH_3+H_2O
Хімічні властивості |
Ацетон має типові хімічні властивості кетонів. Він важко окиснюється, каталітично відновлюється до ізопропілового спирту, реагує по карбонільній групі з нуклеофілами та по α-позиції.
Окисно-відновні реакції |
При відновленні ацетону лужними реагентами і особливо амальгамами магнію або цинку відбувається конденсація і відновлення, що завершуються утворенням пінакону:
Ацетон окиснює вторинні спирти в кетони за присутності трет-бутилату алюмінію (реакція Опенауера[en])
При використанні великого надлишку ацетону реакція зсувається вправо.
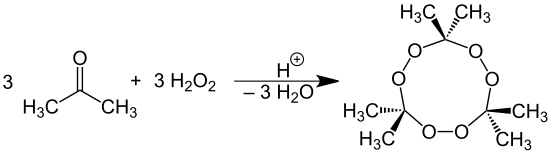
Під дією перекису водню на ацетон в кислому середовищі утворюється перекис ацетону.
Хромовий ангідрид окиснює ацетон до вуглекислого газу та води.
Ацетон реагує з аміаком і воднем у присутності нікелю або міді, утворюючи аміни:
- CH3−CO−CH3+NH3+H2→Ni CH3−CH(NH2)−CH3+H2Odisplaystyle mathrm CH_3-CO-CH_3+NH_3+H_2xrightarrow Ni CH_3-CH(NH_2)-CH_3+H_2O
Зазвичай реакція проходить при температурі 125—175 °С і тиску 5—10 атмосфер.
Приєднання нуклеофілів до карбонільної групи |
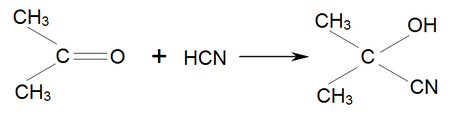
Однією із найважливіших реакцій ацетону є приєднання до нього синильної кислоти, в результаті чого утворюється ацетонціангідрин:
Аналогічно ацетон приєднує хлороформ, утворюючи хлоретон, який застосовується як антисептик:
При конденсації з ацетиленом ацетон утворює диметилкарбінол, який легко перетворюється в ізопрен:
- (CH3)2CO+CH≡CH→5%NaOH, 95−100oC HC≡C−C((CH3)2)OH→H2displaystyle mathrm (CH_3)_2CO+CHequiv CHxrightarrow 5%NaOH, 95-100^oC HCequiv C-C((CH_3)_2)OHxrightarrow H_2
- H2C=CH−C((CH3)2)OH→H2SO4 H2C=CH−C(CH3)=CH2+H2Odisplaystyle mathrm H_2C=CH-C((CH_3)_2)OHxrightarrow H_2SO_4 H_2C=CH-C(CH_3)=CH_2+H_2O
Реакції по α-позиції |
Як і в інших аліфатичних кетонах, в ацетоні протони на вуглеці сусідньому з карбонільною групою доволі кислі й відносно легко вступають в реакції заміщення як в кислому так і в лужному середовищі.
При дії на ацетон металічного натрію або аміду натрію утворюється ацетоннатрій — натрієвий алкоголят ізопропенілового спирту:
- 2CH3−CO−CH3+2Na⟶2CH2=C(ONa)−CH3+H2displaystyle mathrm 2CH_3-CO-CH_3+2Nalongrightarrow 2CH_2=C(ONa)-CH_3+H_2
- CH3−CO−CH3+NH2Na⟶CH2=C(ONa)−CH3+NH3displaystyle mathrm CH_3-CO-CH_3+NH_2Nalongrightarrow CH_2=C(ONa)-CH_3+NH_3
В присутності лугів ацетон легко реагує з галоїдами з утворенням хлороформу, йодоформу і бромоформу:
- CH3−CO−CH3+4NaOH+3Cl2⟶CHCl3+CH3COONa+3NaCl+3H2Odisplaystyle mathrm CH_3-CO-CH_3+4NaOH+3Cl_2longrightarrow CHCl_3+CH_3COONa+3NaCl+3H_2O
Ця реакція протікає через проміжне утворення трихлорацетону.
Реакції в кислому середовищі проходять по іншому механізму. Спочатку протонується карбонільна група, потім відривається протон в α-позиції з утворенням нейтрального енолу який легко всутає в реакції приєднання.
Реакції конденсації |
Реакції приєднання по карбонільній групі чи по α-позиції, що призводять до утворення нових С-С зв'язків називають реакціями конденсації. Оскільки в ацетоні присутні активна карбонільна група і дві активні метильні групи в α-позиціях, він здатен вступати в різноманітні реакції конденсації.
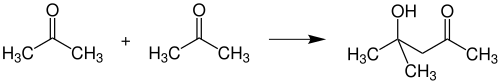
При альдольній конденсації відбувається утворення діацетонового спирту, який застосовують як розчинник:
При кротоновій конденсації послідовно утворюються оксид мезитилу, а потім форон. Оксид мезитилу застосовують для зниження леткості розчинників для лакофарбових покриттів.
- (CH3)2CO+(CH3)2CO→(COOH)2, 120oC (CH3)2C=CH−C(O)−CH3+H2Odisplaystyle mathrm (CH_3)_2CO+(CH_3)_2COxrightarrow (COOH)_2, 120^oC (CH_3)_2C=CH-C(O)-CH_3+H_2O
- (CH3)2C=CH−C(O)−CH3+(CH3)2CO→NaOH, 150−170oC(CH3)2C=CH−C(O)−CH−C(CH3)2+H2Odisplaystyle mathrm (CH_3)_2C=CH-C(O)-CH_3+(CH_3)_2COxrightarrow NaOH, 150-170^oC(CH_3)_2C=CH-C(O)-CH-C(CH_3)_2+H_2O
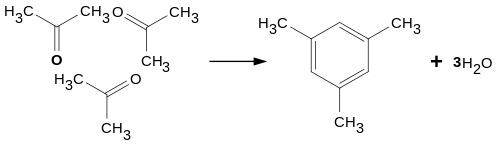
При конденсації трьох молекул ацетону під дією концентрованої сульфатної або хлоридної кислоти утворюється симетричний триметилбензол (мезитилен):
При конденсації ацетону з формальдегідом у присутності невеликих кількостей лугів утворюється ацетоспирт, який при дії йоду або кислот при нагріванні легко відщеплює воду, переходячи в метилвінілкетон:
- CH3−CO−CH3+CH2O⟶CH3−CO−CH2−CH2OH⟶CH3−CO−CH=CH2+H2Odisplaystyle mathrm CH_3-CO-CH_3+CH_2Olongrightarrow CH_3-CO-CH_2-CH_2OHlongrightarrow CH_3-CO-CH=CH_2+H_2O
При конденсації оцтовоетилового естеру з ацетоном отримують ацетилацетон:
- CH3COOC2H5+CH3−CO−CH3⟶CH3−CO−CH2−CO−CH3+C2H5OHdisplaystyle mathrm CH_3COOC_2H_5+CH_3-CO-CH_3longrightarrow CH_3-CO-CH_2-CO-CH_3+C_2H_5OH
Інші реакції |
При піролізі ацетону (500—700 °С) над глиноземом або на розпеченому електричним струмом платиновому дроті в спеціальному приладі — кетенній лампі, утворюється найпростіший кетен:
- 2CH3−CO−CH3+CH2=C(OH)−CH3⟶CH2=C=O+CH4displaystyle mathrm 2CH_3-CO-CH_3+CH_2=C(OH)-CH_3longrightarrow CH_2=C=O+CH_4
Ацетон також вступає з аміаком в реакцію Манніха з утворенням 2,2',6,6'-тетраметилпіперидону-4 з прийнятними виходами.
Застосування |

Каніфоль — здатна розчинятися в ацетоні
Ацетон — дуже добрий розчинник жирів, олив, багатьох смол, нітролаків, сургучу, каніфолі. Ацетон також розчиняє ацетилен, целулоїд, нітро- та ацетилцелюлозу. Каучук, пек та мастикові смоли не розчиняються в ацетоні.
Завдяки своїй малій токсичності, добрій розчинній здатності ацетон дуже широко застосовується на підприємствах хімічної чистки.
При конденсації ацетону в лужному середовищі можна отримати різноманітні продукти[30]. При температурі 10—20 °С в метанольному розчині ацетон димеризується у присутності невеликих кількостей лугу в діацетоновий спирт, з якого одержують гексиленгліколь, оксид мезитилу, метилізобутилкарбінол, метилізобутилкетон, метиловий естер гексиленгліколю. Гексиленгліколь додається переважно до палива. Оксид мезитилу здатен вступати в різні реакції приєднання, наприклад з метанолом в присутності невеликих кількостей лугу. Метилізобутилкетон — дуже важливий розчинник. Метилізобутилкетон і метилізобутилкарбінол є дуже добрими розчинниками для полівінілхлориду, співполімерів вінілхлориду, похідних целюлози, хлорованого каучуку та інших речовин. У більшості випадків за розчинними здібностями вони перевершують естери.

Сургуч
При каталітичній конденсації ацетону в присутності основ при 200 °С поряд з так званими ізоциклітонами утворюється ізофорон, який також є основою для різноманітних синтезів. Сам ізофорон займає виняткове становище як розчинник вінілових лаків. Він надає лакам гарячої сушки блиску і міцності. При обережному гідруванні з ізофорону одержують 3,3,5-триметилциклогексанон, який застосовується на одержання перекисів і служить розчинником. 3,3,5-триметилциклогексанол, який утворюється в результаті повної гідрогенізації ізофорону, є важливим компонентом спеціальних пластифікаторів, особливо у взаємодії з довголанцюговими аліфатичними моно- і дикарбоновими кислотами. Але ще більше значення надають продукту його окиснення нітратною кислотою — α, α, γ-триметиладипіновій кислоті. Цю кислоту етерефікують в спеціальні пластифікатори і перетворюють через диметиловий естер у 2,2,4-триметилгександіол-1, 6 шляхом енергійної гідрогенізації. Крім того, кислоту можна перетворити гідрогенізацією динітрилу в 2,2,4-триметилгексаметилендіамін.
Інший шлях одержання діаміну з ізофорону полягає в дії на нього синильної кислоти та утворенні нітрилу ізофорону — 3,3,5-триметил-5-ціаноциклогексанону, який при спеціальних умовах можна відновити в 1-амінометил-1,3,3-триметил-5-аміноциклогексан (ізофорондіамін). Діаміни легко перевести в діізоціанати і далі використовувати як затверджувачі епоксидних смол. Особливо велика їх роль для виготовлення прозорих поліамідів. Поліаміди застосовуються для виготовлення смол, зв'язних компонентів лаків, клеїв, високоякісних пластмас.
Також в органічному синтезі з ацетону добувають кетен, ізопрен тощо.
Патофізіологічний вплив |
Загальний характер дії |
Наркотик, послідовно вражає всі відділи центральної нервової системи. При вдиханні протягом тривалого часу накопичується в організмі. Токсичний ефект залежить не тільки від концентрації, а й від часу дії. Повільне виділення з організму збільшує можливості хронічного отруєння. Пригнічує деякі мітохондріальні (окиснювальні) ферменти[31].
Вплив на тварин |
При гострому отруєнні у білих мишей бокове положення після 2-годинної експозиції настає при 30—40 мг/л[32]; смерть — при 150 мг/л. У білих щурів бокове положення при 2-годинному впливі 30 мг/л. Концентрації до 10 мг/л не здійснюють впливу навіть через 8 годин. Перші ознаки отруєння встановлені при 25 мг/л через 1,5—3 години. При 50 мг/л рефлекси зникають через 2—2,5 години. У морських свинок і кроликів бокове положення наступало при 2-годинному впливі 72 мг/л. Мінімальні концентрації, що змінюють безумовнорефлекторну діяльність кроликів, 1,25—2,5 мг/л. У мишей, щурів, морських свинок і кроликів концентрації ацетону, що викликали бокове положення, приводили до збільшення вмісту ацетону, ацетооцтової і особливо β-оксимасляної кислоти в крові та сечі[32]. У кішок вдихання 8—10 мг/л протягом 5 годин викликає лише подразнення слизових оболонок носа і очей, сонливість. У собак при 5—6 мг/л і експозиції 7 годин умовні рефлекси не змінюються.
При дослідженнях хронічного отруєння білим щурам давали вдихати 0,00053 мг/л ацетону безперервно протягом 45 діб або 0,2 мг/л щодня по 8 годин. В результаті не було виявлено істотних ознак отруєння[33]. Вплив 0,019 мг/л по 4 години на день протягом 3 тижнів не змінило умовнорефлекторної діяльності[34]. Тварини витримували дію ацетону протягом 9 днів при концентрації в крові 100 мг% і не проявляли жодних ознак отруєння, якщо не враховувати деякої сонливості. При 250 мг% ацетону в крові — слабкість і розлад координації рухів. У мишей і кроликів при щоденних 4-годинних отруєннях концентрацією 8 мг/л протягом більше 3 місяців розвивалося підвищення чутливості до ацетону з погіршенням загального стану. За іншими даними, навпаки, при вдиханні протягом 40 хвилин 1—2 рази на тиждень зростаючих з 1 до 4 мг/л концентрацій спостерігалося «звикання»[35][36]. Вміст ацетону в крові «звиклих» тварин при одній і тій же концентрації його в повітрі був нижчим, ніж у тих, які вперше його вдихали[37]. У кішок повторне отруєння 3—5 мг/л — викликало лише подразнення слизових оболонок.
Вплив на людину |
Поріг сприйняття запаху становить 0,0011 мг/л, поріг дії, що спричиняє виникнення електрокортикального умовного рефлексу, 0,44 мг/л[33]. При вдиханні 1,2 мг/л протягом 3—5 хвилин відбувається подразнення слизових оболонок очей, носа і горла, а вдихання 0,01 мг/л протягом 6 годин підвищувало активність холінестерази крові та коефіцієнт використання кисню. Збільшення вмісту в крові кетонових тіл відбувалося і при впливі 0,001 мг/л; в сечі вміст кетонових тіл не змінювався[38].
У випадку гострого отруєння, у потерпілого вміст ацетону в крові на другий день досягав 18 мг% (норма 1—2 мг%). Ацетон був виявлений також і в сечі; через деякий час в сечі виявляли невелику кількість білка, лейкоцити і еритроцити. Рівень цукру в крові в день отруєння досягав 142 мг%[39].

Ацетон може викликати кон'юктивіт
При одночасному вмісті в повітрі 2,3—3 мг/л ацетону і бутанону відзначені випадки непритомності у робітниць. При застосуванні як розчинника ацетону разом з бутаноном описане отруєння кількох робітників (нездужання, сльозотеча, нетривала непритомність, що супроводжувалася судомами, головний біль). Масове гостре захворювання очей у робітників взуттєвої фабрики (світлобоязнь, сльозотеча, кон'юнктивіти і навіть розлад зору) було викликано ацетонистим спиртом і залежало, очевидно, не стільки від ацетону, скільки від метилового і алілового спиртів. Аналогічні захворювання пояснювалися забрудненням ацетону ацетальдегідом.
За спостереженнями в ході досліджень хронічних отруєнь при концентрації 0,1—0,12 мг/л ацетону у робітників не спостерігалося жодних ознак отруєння, хоча в сечі він постійно визначався; при 0,5-1 мг/л ацетон в крові не визначався протягом тижня. Концентрація 5 мг/л в повітрі при щоденному впливі викликала виникнення в крові до 40 мг% ацетону. При наявності ~0,6 мг/л ацетону в повітрі (у присутності бутилацетату та етилового спирту) відзначалися ознаки отруєння. Спостерігалися зміни з боку верхніх дихальних шляхів, частіше у формі атрофічних катарів, анемія, зсув вліво лейкоцитарної формули, зниження апетиту. У деяких робітників у сироватці крові було виявлено зниження рівня альбумінів і підвищення рівня α-, β- і γ-глобулінів, а також загальних ліпідва, без інших симптомів інтоксикації.
Дія на шкіру |
При зануренні вуха кролика в ацетон на 3 години або при нанесенні чистого ацетону на вистрижену шкіру живота на 6 годин місцевої дії майже непомітно. При накладенні компресів з ацетону виявлені зміни в периферичній нервовій системі, найбільш чутливими виявляються мозкові нервові волокна.
Компреси з ацетону, накладені людині на плече на добу, викликали незначне почервоніння, яке незабаром зникало. У робітників на ділянках шкіри, на які протягом робочого дня діяв ацетон, зменшувався pH і кількість холестерину, пригнічувалась функція сальних залоз[40].
Потрапляння в організм та поведінка в ньому |
Рідкий ацетон може всмоктуватися через шкіру. Ацетон з'являється в крові відразу після початку вдихання, його концентрація поступово наростає до встановлення динамічної рівноваги. Вміст у тканинах становить наступний ряд: головний мозок → селезінка → печінка → підшлункова залоза → нирки → легені → м'язи → серце. Мічений вуглець, що входить в молекулу ацетону, виявлений у складі глікогену, сечі, холестерину, жирних і амінокислот. Ацетон метаболізується повніше при вдиханні невисоких концентрацій. З повітрям, що видихається, виділяється незмінений ацетон, а при його окисненні утворюється CO2displaystyle mathrm CO_2 . Ацетон виділяється також через нирки і шкіру[41].
«Аналіз на ацетон» |
Ацетон, ацетооцтова і бетаоксимасляна кислота, об'єднуються під загальною назвою ацетонові тіла. Це продукти неповного окислення жирів і частково білків, тісно пов'язані між собою.
За нормального стану організму ацетонові тіла в загальному аналізі сечі відсутні. Слід зазначити, що за добу з сечею таки виділяється незначна кількість цих сполук, проте такі концентрації не можуть бути визначені звичайними методами, що застосовуються в лабораторіях. Тому прийнято вважати, що в нормі в сечі ацетонових тіл немає.
Ацетонові тіла виявляються в загальному аналізі сечі при порушенні обміну вуглеводів і жирів. Таке порушення супроводжується збільшенням кількості ацетонових тіл в тканинах в крові (кетонемія). Вміст у сечі ацетонових тіл називається кетонурією.
За нормальних умов організм черпає енергію в основному з глюкози. Глюкоза накопичується в організмі, в першу чергу в печінці, у вигляді глікогену. Глікоген утворює енергетичний резерв, який можна швидко мобілізувати при необхідності компенсації раптової недостачі глюкози.
При фізичних і емоційних навантаженнях, при хворобах з підвищеною температурою та інших підвищених витратах енергії запаси глікогену вичерпуються, організм починає отримувати енергію із запасів жиру. При розпаді жиру утворюються ацетонові тіла, які виводяться з сечею. Якщо з ацетоновими тілами в загальному аналізі сечі виявляється глюкоза, то це ознака цукрового діабету. Також ацетонові тіла в загальному аналізі сечі з'являються в наслідок зневоднення організму, при різкому схудненні, гарячці, голодуванні, важких отруєннях із сильною блювотою і проносом.
Див. також |
| Вікісховище має мультимедійні дані за темою: Ацетон |
- Бутанон
- Ізопропіловий спирт
- Ацетонові тіла
- Кетони
Примітки |
↑ абв CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
↑ Howard, William L. Acetone // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — P. 93. — ISBN 978-0-471-48517-9. — DOI: (англ.)
↑ Березов Т. Т., Коровкин Б. Ф., Биологическая химия: Учебник / Под. ред. акад. АМН СССР С. С. Дебова.— 2-е изд., перераб. и доп.— М.: Медицина,— 1990.— 528 с. ISBN 5-225-01515-8 (рос.)
↑ Постанова Кабінету міністрів України №770 від 6 травня 2000 року «Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів»
↑ Ullmann, Enzyklopadie der technischen Chemie, München, Bd. 1, 1951, S. 106. (нім.)
↑ Патент США 1329214, 1920. (англ.)
↑ J. H. Northrop et al., Industrial & Engineering Chemistry, 11, 723 (1919). (англ.)
↑ W. H. Peterson et al., Industrial & Engineering Chemistry, 13, 757 (1921). (англ.)
↑ Німецький патент 298851, 1916. (нім.)
↑ Англійський патент 299048, 1928. (англ.)
↑ Англійський патент 313897, 1928. (англ.)
↑ Англійський патент 330350, 1929. (англ.)
↑ Англійський патент 472093, 1936. (англ.)
↑ Англійський патент 173539, 1920. (англ.)
↑ Патент США 1365035, 1918. (англ.)
↑ Патент США 1497817, 1918. (англ.)
↑ Патент США 1952702, 1933. (англ.)
↑ Патент США 1895516, 1933. (англ.)
↑ Патент США 1895528, 1933. (англ.)
↑ Патент США 1895529, 1933. (англ.)
↑ J. Smidt et. al., Angewandte Chemie, 71, 176–182 (1959). (нім.)
↑ W. Hafner et al., Chemische Berichte, 95, 1575–1581 (1962). (нім.)
↑ J. Smidt, H. Krekeler, Erdol und Kohle, 16, (6-1), 560–563 (1963). (нім.)
↑ J. Smidt, Chemistry & Industry, 1962, 54—61. (англ.)
↑ Англійський патент 884962, 1961. (англ.)
↑ Англійський патент 878777, 1961. (англ.)
↑ Бельгійський патент 620834, 1963. (фр.)
↑ Французький патент 1397639, 1965. (фр.)
↑ Італійський патент 640465, 1962. (італ.)
↑ К. Schmitt, Chemische Industrie, 18, № 4, 204–210 (1966). (нім.)
↑ Clark H., Powis G. Biochemical Pharmacology, 1974, v. 23. № 5, p. 1015–1019. (англ.)
↑ аб Линючева Л. А. и др. Фармакология и токсикология, 1969, № 4, с. 465–467. (рос.)
↑ аб Фельдман Ю. Г. В кн.: Предельно допустимые концентрации атмосферных загрязнений. Вып. 6. М., 1962, с. 109–127. (рос.)
↑ Batting К., Grandjen Е. Archives of Environmental Health, 1964, v. 9. № 6, p. 745–749. (англ.)
↑ Кулинченко В. П. В кн.: Конференция молодых научных работников. Тезисы докладов. Институтт гигиены труда и проф. заболев. АМН СССР, 1964, с. 30—31. (рос.)
↑ Олюпин И. В., Проблемы гигиены труда и проф. заболев. Вып. I. Иркутск, 1964, с, 12—19;: 20—31. (рос.)
↑ Добрынина В. В. В кн.: Материалы II конференции молодых научных работников. Лен. ин-та гиг. труда и проф. заболев. Л. 1968, с. 46-49. (рос.)
↑ Михайлов В. И., Пилипюк З. И. Гигиена труда, 1968, № 1, с. 57—60. (рос.)
↑ Ross D. S. The Annals of Occupational Hygiene, 1973, v. 16, № 1, p. 73—75. (англ.)
↑ Рогайлин В. И. Гигиена труда, 1966, № 2, с. 23—25. (рос.)
↑ Eagle J., American Industrial Hygiene Association Journal, 1973, v. 34, № 12, p. 533–539. (англ.)
Джерела |
Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Ленинград : Химия, 1976. — Т. 1. — С. 529-533. — 49000 прим. (рос.)
Шейхет Ф. И. Материаловедение химикатов, красителей и моющих средств. — Москва : Легкая индустрия, 1969. — С. 62-71. — 18000 прим. (рос.)
Химическая энциклопедия / Под. ред. Кнунянц И. Л. — Москва : Советская энциклопедия, 1988. — Т. 1. (рос.)
Теддер Дж., Нехватал А., Джубб А. Промышленная органическая химия. — Москва : Мир, 1977. — 704 с. (рос.)
Посилання |
Ацетон Фармацевтична енциклопедія
Запах ацетону з рота. Архів оригіналу за 2013-06-20.
Ацетон. Школа доктора Комаровського. Архів оригіналу за 2013-06-20.
Ацетон буває різним. Архів оригіналу за 2013-06-20.
| Ця стаття належить до добрих статей української Вікіпедії. |