Хром
| Хром (Cr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомний номер | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Зовнішній вигляд простої речовини | дуже твердий метал сірого кольору  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Властивості атома | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Атомна маса (молярна маса) | 51,9961 а.о.м. (г/моль) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радіус атома | 130 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Енергія іонізації (перший електрон) | 652,4(6,76) кДж/моль (еВ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронна конфігурація | [Cr] 3d5 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хімічні властивості | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентний радіус | 118 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радіус іона | (+6e)52 (+3e)63 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Електронегативність (за Полінгом) | 1,66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електродний потенціал | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ступені окиснення | 6, 3, 2, 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термодинамічні властивості | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина | 7,18 г/см³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярна теплоємність | 23,35 Дж/(К·моль) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопровідність | 93,9 Вт/(м·К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавлення | 2130 К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавлення | 21 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипіння | 2945 К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота випаровування | 342 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярний об'єм | 7,23 см³/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристалічна ґратка | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура ґратки | кубічна об'ємноцентрована | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Період ґратки | 2,880 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Відношення с/а | n/a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура Дебая | 630[1] К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Хром у Вікісховищі? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Хром — хімічний елемент, із символом Cr і атомним номером 24, перший елемент шостої групи.
Зміст
1 Історія
2 Походження назви
3 Загальний опис
4 Поширеність
5 Фізичні властивості
6 Ізотопи
7 Хімічні властивості
7.1 Проста речовина
7.2 Сполуки Хрому (+2)
7.3 Сполуки Хрому (+3)
7.4 Сполуки Хрому (+4)
7.5 Сполуки Хрому (+6)
8 Отримання
9 Застосування
10 Біологічна роль
11 Див. також
12 Примітки
13 Література
14 Посилання
Історія |
У 1766 році в околицях Єкатеринбурга був виявлений мінерал, який отримав назву «сибірський червоний свинець», PbCrO4. Сучасна назва — крокоїт. У 1797 французький хімік Л. Н. Воклен виділив з нього новий тугоплавкий метал (швидше за все Л. Н. Воклен отримав карбід хрому).
Походження назви |
Назва походить від грец. χρωμα — колір, завдяки яскравій забарвленості його сполук.
Загальний опис |
Хром — це сталево-сірий, блискучий, твердий та крихкий метал[2], що має високу температуру плавлення. Назва елемента походить від грецького слова «chrōma» (χρώμα), що означає кольоровий[3], оскільки багато його сполук інтенсивно забарвлені.
Оксид хрому використовували китайці в династії Цінь ще 2000 років тому для покриття металевої зброї. Хром був виявлений як елемент після того, як у поле зору західного світу потрапив червоний кристалічний мінерал крокоїт (хромат свинцю (II) хромату), виявлений у 1761 році. Спочатку використовувався як пігмент. Луї Ніколя Воклен першим виділив металевий хром з мінералу в 1797 році.
Металічний хром та сплав ферохрому добувається з хромітів силікотермічною чи алюмінотермічною реакцію. Хром має високий корозійний опір і твердість. Його додають при виробництві нержавіючої сталі. Цей процес, разом з хромуванням, складають 85 % комерційного використання елемента.
Тривалентний іон Хрому, можливо, знаходиться у слідових кількостях в ліпідіах, хоча це питання залишається в дебатах[4]. У великих кількостях сполуки металу можуть бути токсичними та канцерогенними. Найвідомішим прикладом токсичної сполуки є шестивалентний хром (Cr(VI)).
Поширеність |

Крокоїт (PbCrO4)

хромітна руда
Хром — 24-й елемент за поширеністю самих у земній корі із середньою концентрацію 100 частин на мільйон.[5] Сполуки хрому перебувають в навколишньому середовищі внаслідок ерозії хромсовмісних порід або вивержень вулканів. Діапазон концентрацій у ґрунті становить від 1 до 300 мг/кг, у морській воді від 5 до 800 мкг/л, у річках та озерах 26 мкг/літр до 5.2 мг/л.[6]
Метал видобувають з хроміту(FeCr2O4)[7]. Близько двох п'ятих хромітових руд і концентратів у світі виробляються в Південній Африці. Видобуванням хромітів також займається Казахстан, Індія, Росія і Туреччина. Нерозвинені родовища хромітів зосереджені в Казахстані та Південній Африці.[8]
Хоч і рідко, існують поклади самородного хрому[9][10]. У Росії виробляються зразки самородного металу. У шахті «Удачній», багатій на кімберліт та діаманти у відновному середовищі добувається елементарний хром і алмаз.[11]
Фізичні властивості |
У вільному вигляді хром — сірий метал з кубічною об'ємно-центрованою ґраткою, а = 0,28845 нм.
Це єдина елементарна тверда сполука, яка виявляє антиферомагнітні властивості при кімнатній температурі (і нижче). При температурі вище 38 °C він перетворюється в парамагнетик.
Хром має твердість за шкалою Мооса 5[12], найтвердіший із чистих металів. Дуже чистий хром достатньо добре піддається механічній обробці.
Металічний хром на повітрі пасивує під дією кисню, утворюючи тонкий захисний шар поверхневого оксиду. Шар, що складається лише з кількох атомів завтовшки, є дуже щільним і, на відміну від заліза або нелегованої сталі, запобігає дифузії кисню в матеріал та виникненню іржі[13]. Пасивація може бути підвищена шляхом короткочасного контакту з такою кислотою-окисником як азотна. Протилежний ефект досягається при обробці сильним відновником, який руйнує захисний оксидний шар на металі. Хром, оброблений таким способом, легко розчиняється в навіть в слабких кислотах.
Ізотопи |
Природний хром складається з трьох стабільних ізотопів: 52Cr, 53Cr і 54Cr; 52 Cr є найбільш поширеним (83.789 %). Із 19 досліджених радіоізотопів найбільш стабільним є 50Cr з періодом напіврозпаду більше 1.8×1017 років, а для 51Cr період напіврозпаду становить 27,7 днів. Усі інші радіоактивні ізотопи мають періоди напіврозпаду менше 24 годин, більшість з них мають — менше 1 хвилини. Цей елемент також має 2 метастани.[14]
Всього відомо 25 ізотопів хрому з 42Cr по 67Cr.
Хімічні властивості |
Хром є елементом перехідних металів, перший елемент шостої групи. Хром (0) має електронну конфігурацію 4s13d5. Метал володіє широким спектром можливих окиснення, де +3 є найбільш енергетично стабільним, тому сполуки Хрому +3 і +6 більш характерні, у той час як +1, +4 і +5 — рідкісні.
| Ступені окиснення | |
|---|---|
| 0 | Cr(C6H6)2 |
| +1 | K3[Cr(CN)5NO] |
| +2 | CrCl2 |
| +3 | CrCl3 |
| +4 | K2CrF6 |
| +5 | K3CrO8 |
| +6 | K2CrO4 |
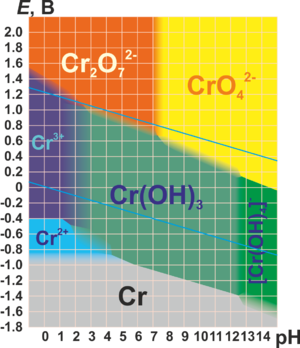
Нижче наведена Діаграма Пурбе для хрому в чистій воді, соляній кислоті або гідроксиді натрію:
Проста речовина |

Хром нітрид Cr3N2
Стійкий на повітрі за рахунок пасивації, не реагує з нітратною кислотою. З хлоридною кислотою в інертному середовищі взаємодіє, окиснюючись до двохвалентного хлориду. Реакція з концентрованою сульфатною кислотою протікає наступним чином:
2 Cr+6 H2SO4⟶displaystyle mathrm 2 Cr+6 H_2SO_4longrightarrow Cr2(SO4)3+2 SO2+6 H2O displaystyle mathrm Cr_2(SO_4)_3+2 SO_2+6 H_2O
При 2000 ° C згоряє з утворенням зеленого оксиду хрому(III) Cr2O3, що володіє амфотерними властивостями. Синтезовано сполуки хрому з бором (бориди Cr2B, CrB, Cr3B4, CrB2, CrB4 та Cr5B3), з вуглецем (карбіди Cr23C6, Cr7C3 та Cr3C2), c кремнієм (силіциди Cr3Si, Cr5Si3 і CrSi) і азотом (нітриди CrN і Cr2N).
Сполуки Хрому (+2) |
Ступені окиснення +2 відповідає основний оксид CrO чорного кольору. Солі Cr2+ (розчини блакитного кольору) утворюються при відновленні солей Cr3+ або дихроматів цинком в кислому середовищі (воднем в момент виділення):
- 2Cr3+→Zn,HCl[H]2Cr2+displaystyle mathrm 2Cr^3+xrightarrow[Zn,HCl][H]2Cr^2+
Солі Cr2+ — сильні відновники, при стоянні витісняють водень із води[15]. Киснем повітря, особливо в кислому середовищі, Cr2+ окиснюється, внаслідок чого блакитний розчин швидко зеленіє:
4 CrSO4+2 H2SO4+O2⟶displaystyle mathrm 4 CrSO_4+2 H_2SO_4+O_2longrightarrow Cr2(SO4)3+2 H2O displaystyle mathrm Cr_2(SO_4)_3+2 H_2O
Коричневий або жовтий гідроксид Cr(OH)2 осідає при додаванні лугів до розчинів солей хрому(II).
Синтезовано дигалогеніди CrF2, CrCl2, CrBr2 та CrI2.
Сполуки Хрому (+3) |

Хром(III) хлорид
Ступені окиснення +3 відповідає амфотерний оксид Cr2O3 та гідроксид Cr(OH)3 (обидва зеленого кольору). Це найбільш стійка ступінь окиснення для хрому. Його сполуки мають колір від брудно-лілового (іон [Cr(H2O) 6]3+) до зеленого (в координаційній сфері присутні аніони).
Cr3+ схильний до утворення подвійних сульфатів виду MICr(SO4) 2·12H2O (галунів)
Гідроксид хрому(III) отримують, діючи амоніаком на розчини солей хрому(III) :
- Cr3++3NH3+3H2O→Cr(OH)3↓+3NH4+displaystyle mathrm Cr^3++3NH_3+3H_2Orightarrow Cr(OH)_3downarrow +3NH_4^+
Можна використовувати розчини лугів, але при їх надлишку утворюється розчинний гідроксокомплекс:
- Cr3++3OH−→Cr(OH)3↓displaystyle mathrm Cr^3++3OH^-rightarrow Cr(OH)_3downarrow
- Cr(OH)3+3OH−→[Cr(OH)6]displaystyle mathrm Cr(OH)_3+3OH^-rightarrow [Cr(OH)_6]
Сплавлені Cr2O3 з лугами отримують хроміти:
- Cr2O3+2NaOH→2NaCrO2+H2Odisplaystyle mathrm Cr_2O_3+2NaOHrightarrow 2NaCrO_2+H_2O
Непрожарений оксид хрому(III) розчиняється в лужних розчинах і в кислотах:
- Cr2O3+6HCl→2CrCl3+3H2Odisplaystyle mathrm Cr_2O_3+6HClrightarrow 2CrCl_3+3H_2O
При окисненні сполук хрому(III) в лужному середовищі утворюються сполуки хрому(VI) :
- 2Na3[Cr(OH)6]+3H2O2→2Na2CrO4+2NaOH+8H2Odisplaystyle mathrm 2Na_3[Cr(OH)_6]+3H_2O_2rightarrow 2Na_2CrO_4+2NaOH+8H_2O
Те ж саме відбувається при сплавленні оксиду хрому(III) з лугом та окислювачами, або з лугом на повітрі (розплав при цьому набуває жовтого забарвлення):
- 2Cr2O3+8NaOH+3O2→4Na2CrO4+4H2Odisplaystyle mathrm 2Cr_2O_3+8NaOH+3O_2rightarrow 4Na_2CrO_4+4H_2O
Сполуки Хрому (+4) |
При обережному розкладанні оксиду хрому(VI) CrO3 в гідротермальних умовах отримують хром(IV) оксид CrO2, який є феромагнетиком і має металеву провідність.
Серед тетрагалогенідів хрому стійким є флуорид CrF4, а тетрахлорид хрому CrCl4 існує лише в парах.
Сполуки Хрому (+6) |

Хромат натрію
Ступені окислення +6 відповідає кислотний оксид хрому(VI) CrO3 та цілий ряд кислот, між якими існує рівновага. Найпростіші з них — хроматна H2CrO4 та дихроматна H2Cr2O7. Вони утворюють два ряди солей: жовті хромати та помаранчеві дихромати відповідно.
Оксид хрому(VI) CrO3 утворюється при взаємодії концентрованої сірчаної кислоти з розчинами дихроматів. Типовий кислотний оксид, при взаємодії з водою він утворює сильні нестійкі хромові кислоти: хромову H2CrO4, дихромову H2Cr2O7 та інші ізополікислоти із загальною формулою H2CrnO3n+1. Збільшення ступеня полімеризації відбувається зі зменшенням рН, тобто збільшенням кислотності:
- 2CrO42−+2H+→Cr2O72−+H2Odisplaystyle mathrm 2CrO_4^2-+2H^+rightarrow Cr_2O_7^2-+H_2O
Але якщо до помаранчевого розчину K2Cr2O7 прилити розчин лугу, забарвлення знову переходить в жовте, оскільки знову утворюється хромат K2CrO4:
- Cr2O72−+2OH−→2CrO42−+H2Odisplaystyle mathrm Cr_2O_7^2-+2OH^-rightarrow 2CrO_4^2-+H_2O
До високого ступеня полімеризації, як це відбувається у вольфраму та молібдену, не доходить, оскільки поліхромова кислота розпадається на оксид хрому(VI) і воду:
- H2CrnO3n+1→H2O+nCrO3displaystyle mathrm H_2Cr_nO_3n+1rightarrow H_2O+nCrO_3
Розчинність хроматів приблизно відповідає розчинності сульфатів. Зокрема, жовтий хромат барію BaCrO4 випадає при додаванні солей барію як до розчинів хроматів, так і до розчинів дихроматів:
- Ba2++CrO42−→BaCrO4↓displaystyle mathrm Ba^2++CrO_4^2-rightarrow BaCrO_4downarrow
- 2Ba2++Cr2O72−+H2O→2BaCrO4↓+2H+displaystyle mathrm 2Ba^2++Cr_2O_7^2-+H_2Orightarrow 2BaCrO_4downarrow +2H^+
Відомі пентафлуорид хрому CrF5 та малостійкий гексафлуорид хрому CrF6. Також отримані леткі оксогалогеніди хрому CrO2F2 та CrO2Cl2.
Сполуки хрому(VI) — сильні окисники, наприклад:
- K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7H2Odisplaystyle mathrm K_2Cr_2O_7+14HClrightarrow 2CrCl_3+2KCl+3Cl_2uparrow +7H_2O
Додавання до дихромату перекису водню, сірчаної кислоти та органічного розчинника (етеру) призводить до утворення синього пероксиду хрому CrO5L (L — молекула розчинника), який екстрагується в органічний шар; ця реакція використовується як аналітична.
K2Cr2O7+4 H2O2+ H2SO4⟶displaystyle mathrm K_2Cr_2O_7+4 H_2O_2+ H_2SO_4longrightarrow 2 CrO5⋅(C2H5)2O+ K2SO4+5 H2Odisplaystyle mathrm 2 CrO_5cdot (C_2H_5)_2O+ K_2SO_4+5 H_2O
Отримання |

Злиток хрому добутий алюмотермічно
Хроміт заліза (хромистий залізняк) при 1200 °C перетворюють в хромат:
4 FeCr2O4+8 Na2CO3+7 O2⟶displaystyle mathrm 4 FeCr_2O_4+8 Na_2CO_3+7 O_2longrightarrow 8 Na2CrO4+2 Fe2O3+8 CO2 displaystyle mathrm 8 Na_2CrO_4+2 Fe_2O_3+8 CO_2
Хромат розчиняють у воді і сірчаною кислотою переводять у дихромат:
2 Na2CrO4+H2SO4⟶displaystyle mathrm 2 Na_2CrO_4+H_2SO_4longrightarrow Na2Cr2O7+Na2SO4+H2O displaystyle mathrm Na_2Cr_2O_7+Na_2SO_4+H_2O
Дихромат натрію кристалізується при охолоджені як дигідрат. При наступному відновленні вуглецем отримують Хром(III) оксид:
Na2Cr2O7⋅2 H2O+2 C⟶displaystyle mathrm Na_2Cr_2O_7cdot 2 H_2O+2 Clongrightarrow Cr2O3+Na2CO3+2 H2O+CO displaystyle mathrm Cr_2O_3+Na_2CO_3+2 H_2O+CO
У кінцеві стадії відновлюють хром алюмотермічно:
- Cr2O3+2 Al⟶Al2O3+2 Cr displaystyle mathrm Cr_2O_3+2 Allongrightarrow Al_2O_3+2 Cr
Застосування |
На початку ХIX ст. сполуки хрому використовувалися як вогнетривкий матеріал для футерування металургійних печей, отримання фарб і дублення шкіри. В кінці ХIX ст. хром почали широко використовувати для легування сталі. Сьогодні основним споживачем хромітів є металургійна промисловість (65 %), значно менше — промисловість вогнетривів (18 %) і хімічна (17 %) промисловість. Хром — один з основних компонентів неіржавної жароміцної, кислототривкої сталі і важливого інгредієнта корозійностійких і жароміцних суперсплавів. Добавка ферохрому (65-70 % Cr, 5-7 % С, інше — Fe) або чарж-хрому (54 % Cr, 6-7 % С, інше Fe) до сталей підвищує їх в'язкість, твердість і антикорозійні властивості (нержавіючі, жароміцні, кислототривкі, інструментальні і інші види сталей). Сплави хрому з кобальтом, вольфрамом або молібденом використовуються як антикорозійні покриття (хромування). Штучний радіоактивний ізотоп 51Cr — ізотопний індикатор. Сполуки хрому застосовують як фарби, окисники, дубильні речовини, протрави при фарбуванні.
Хром та його аналоги широко використовують як легувальні додатки до спеціальних неіржавних сталей, які містять більше 10 % хрому. При меншому вмісті хрому сталь набуває значної міцності та твердості. Сплав нікелю з хромом ніхром (80 % Ni, 20 % Cr) має високу температуру плавлення, його використовують в нагрівальних елементах печей, які дають можливість досягти температури +1100 °C.
Біологічна роль |

Кристали хрому і куб 1 см³ для порівняння
Хром відіграє важливу біологічну роль в організмі людини. Він позитивно впливає на процеси кровотворення, а також на ферментативні системи. У складі ферменту трипсину Хром бере участь у процесі травлення. Вченими встановлено, що вилучення Хрому з харчового раціону тварин приводить до підвищення у крові та сечі глюкози. Додавання Хрому до їжі хворим на діабет нормалізує вуглеводний обмін. Хром в організм людини потрапляє з такими продуктами харчування, як соя, кукурудзяна та вівсяна крупи. Добова потреба організму в Хромі становить 5-10 мг.
Див. також |
- Хромові руди
- Ресурси і запаси хрому
- Хромати природні
- Кислоти хрому
Примітки |
↑ A Course In Thermodynamics, Volume 2(англ.)
↑ Brandes, E. A.; Greenaway, H. T.; Stone, H. E. N. (1956). Ductility in Chromium. Nature 178 (587): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0.
↑ χρώμα, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
↑ Cronin, Joseph R. (2004). The Chromium Controversy. Alternative and Complementary Therapies 10 (1): 39–42. doi:10.1089/107628004772830393.
↑ Emsley, John (2001). Chromium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. с. 495–498. ISBN 0-19-850340-7.
↑ Kotaś, J.; Stasicka, Z (2000). Chromium occurrence in the environment and methods of its speciation. Environmental Pollution 107 (3): 263–283. PMID 15092973. doi:10.1016/S0269-7491(99)00168-2.
↑ National Research Council (U.S.). Committee on Biologic Effects of Atmospheric Pollutants (1974). Chromium. National Academy of Sciences. с. 155. ISBN 978-0-309-02217-0.
↑ Papp, John F. Commodity Summary 2009: Chromium. United States Geological Survey. Процитовано 2009-03-17.
↑ Fleischer, Michael (1982). New Mineral Names. American Mineralogist 67: 854–860.
↑ Chromium (with location data), Mindat
↑ Chromium from Udachnaya-Vostochnaya pipe, Daldyn, Daldyn-Alakit kimberlite field, Saha Republic (Sakha Republic; Yakutia), Eastern-Siberian Region, Russia, Mindat
↑ Поварьонних А. С. Твердість мінералів. — К. : АН УРСР, 1963. — С. 197-208.
↑ Wallwork, G. R. (1976). The oxidation of alloys. Reports on the Progress Physics 39 (5): 401–485. Bibcode:1976RPPh...39..401W. doi:10.1088/0034-4885/39/5/001.
↑ Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center) 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
↑ Некрасов Б. В. Курс общей химии. — М.: ГНХТИ, 1952. — С. 334
Література |
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2004—2013.
Посилання |
ХРОМ //Фармацевтична енциклопедія


![mathrm2Cr^3+ xrightarrow[Zn, HCl][H] 2Cr^2+](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e3aef7546ffcc1490cf3d723d8762f50abc43ef)




![mathrmCr(OH)_3 + 3OH^-rightarrow [Cr(OH)_6]](https://wikimedia.org/api/rest_v1/media/math/render/svg/07a95033761d3cfef2870dc9afbd450963f6b59f)


![mathrm2Na_3[Cr(OH)_6] + 3H_2O_2 rightarrow 2Na_2CrO_4 + 2NaOH + 8H_2O](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc8d2208f4819d615cfc1968d0315d446139013)















